蛙病毒(Ranavirus)是一类感染鱼类、两栖类、爬行类等动物的双链DNA病毒,属于虹彩病毒科Iridoviridae[]。其感染宿主至少包括52个科175种野生或养殖的变温脊椎动物,故又被称为“冷血动物杀手”[]。同时蛙病毒具有极强的传播能力,随着近年动物国际化贸易逐渐频繁与规模的扩大,蛙病毒在全球两栖类、爬行类以及鱼类中的传播呈现愈加严重的趋势[]。张奇亚等[]1996年从患有溃疡性致死综合症的沼泽绿牛蛙Rana grylio分离到蛙病毒,并命名为沼泽绿牛蛙病毒(Rana grylio virus,RGV);随后王晓红等[]在人工养殖虎纹蛙R. tigrina中又分离得到虎纹蛙病毒(Tiger frog virus,TFV);2011年耿毅等[]也对由蛙病毒导致的人工养殖中国大鲵Andrias davidianus大规模死亡事件进行了报道。在过去的20年内,已相继有鲈鱼Micropterus salmoides[]、林蛙R. dybowskii[]、牛蛙R. catesbieana、甲鱼Trionyx Sinensis[]以及似鲇高原鳅Triplophysa siluorides[]等多种动物感染蛙病毒并导致大量死亡的报道,给中国养殖业的发展与珍稀物种的保护造成了严重的危害。
黑斑蛙R. nigromaculata是我国的一种重要特色养殖蛙类,但近年来红腿病、红斑症、腹水病和烂皮病等流行疾病的不断发生造成了巨大的经济损失[-],严重影响了黑斑蛙养殖业的发展。自2012年以来,四川成都、绵阳等地的黑斑蛙养殖场陆续爆发由未知病原引起的高死亡率传染病,患病蝌蚪全身多处出血、肿胀,发病1周左右死亡率即可达90%以上。为明确其病因,本研究从四川某养殖场患病蝌蚪体内进行了病原的分离,通过回归感染验证其病原性,并对该病原进行了形态学、病理损伤观察和分子生物学鉴定,旨在为该病的诊断与防控提供依据与参考。
1 材料与方法1.1 试验材料
患病黑斑蛙蝌蚪,由四川双流某养殖场送检,体长(1.85±0.25) cm,体质量(2.6±0.5) g;健康黑斑蛙蝌蚪购自四川德阳某黑斑蛙养殖场,体长(2.20±0.22) cm,体质量(3.0±0.5) g,体表健康无损伤。胎牛血清(FBS)、M199培养基、体积分数为0.25%的胰酶溶液(含EDTA)、抗生素均购自Hyclone公司;DPBS、pMD-19T质粒连接试剂盒、PCR-Mix reaction buffer、DNA提取试剂盒、DNA胶回收试剂盒和DNA分子质量标准DL-2000均购自上海生物工程有限公司。
1.2 临床症状观察及细菌学检查
仔细观察送检蝌蚪体表情况,随后在无菌环境下解剖,取肝脏、腹水进行组织涂片,革兰染色后镜检,同时划线接种于BHI琼脂平板,在28 ℃条件下培养24~48 h,观察平板细菌生长情况。
1.3 组织病理学检查
将患病蝌蚪剪开腹部并去除尾部,置于体积分数为10%的中性福尔马林固定,常规石蜡切片,HE染色,中性树胶封片后光学显微镜下观察其主要病变。
1.4 病毒分离
取患病蝌蚪内脏组织剪碎后放入组织匀浆器内,按1∶5的体积比加入混有抗生素的M199培养基(青链霉素活性为1 000 U·mL–1)于冰上均浆成悬液。4 ℃下放置过夜后,8 000 r·min–1离心20 min,经0.22 μm孔径滤器过滤后,接种于鲤鱼上皮瘤(Epithelioma papulosum cyprini,EPC)细胞,25 ℃培养,逐日观察细胞病变效应(Cytopathic effect,CPE)。待80%以上细胞出现病变后,收获病毒保存于–80 ℃备用,并按照Reed-Muech法[]计算病毒半数感染量(TCID50)。
1.5 人工感染试验
人工感染试验在室内塑料水族箱中进行,水温(22±2) ℃,健康黑斑蛙蝌蚪室内暂养7 d后,分为试验组与对照组,每组20尾。试验组:取5 L曝气水与10 mL病毒液(TCID50=108 mL–1)混匀,然后将20尾蝌蚪放入其中浸泡8 h,浸泡结束后用干净的曝气水将其全部更换;对照组:按试验组同等操作,但将加入的10 mL病毒液换为10 mL M199培养液。试验期3周,每日观察蝌蚪的发病、死亡情况。
1.6 电镜观察
EPC细胞接种病毒后,待出现50 %以上CPE时吸去细胞维持液,加入体积分数为2.5%的戊二醛进行固定,3 000 r·min–1离心10 min,收集细胞沉淀经PBS溶液重悬洗涤后,10 000 r·min–1离心30 min,重新加入体积分数为2.5%的戊二醛于4 ℃条件下避光固定,然后按常规方法经固定、脱水、包埋后进行切片,最后透射电镜观察。
1.7 MCP基因的PCR检测
参考Mao等[]针对蛙病毒MCP基因5′端500 bp大小片段设计的特异性引物进行PCR扩增,上游引物:5′-GACTTGGCCACTTATGAC-3′;下游引物:5′-GTCTCTGGAGAAGAA-3′。DNA扩增模板样本来源包括自然患病蝌蚪组织匀浆液、自然患病蝌蚪饲养水源样本(样本的制备参考吴楚等[]的NaCl-AlCl3·6H2O沉淀法)以及已分离的病毒液,然后通过DNA提取试剂盒提取DNA作为扩增模板。PCR反应体系(12.5 μL):8.5 μL ddH2O,2 μL引物,2 μL模板DNA。反应条件:94 ℃预变性5 min;94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1 min,共30个循环;最后,72 ℃延伸10 min。随后用10 g·L–1的琼脂糖凝胶电泳检测PCR扩增产物的大小。
1.8 MCP基因克隆测序及系统发育分析
参照合成Huang等[]扩增蛙病毒MCP全基因序列引物,上游引物:5′-ACAGTCACCGTGTATCTTA-3′;下游引物:5′-GGAAAAGACTTTGCGCTGAA-3′。扩增的DNA模板为采用DNA提取试剂盒从已分离的病毒液中提取的DNA。PCR反应体系和条件同“1.7”。
10 g·L–1琼脂糖凝胶电泳检测PCR扩增产物大小,并将产物纯化后送成都擎科梓熙生物技术有限公司测序。测序结果提交GenBank,并根据NCBI中收录的其他虹彩病毒MCP基因序列,采用Mega5.0软件中的邻近法(Neighbor-Joining,NJ)构建系统发育树。
2 结果与分析2.1 临床特征与细菌学检查
黑斑蛙患病蝌蚪主要表现为摄食减少甚至不摄食、活动减少、游动缓慢,并可见腹部肿胀,下颌与腹部等体表出血(),发病水温约22 ℃,病程较急,1周内蝌蚪的死亡率达约90%。剖检可见腹腔内有淡黄色腹水,肝肿大充血,肠道空虚且腔内充有大量黏液。

图 1 黑斑蛙患病蝌蚪临床症状Fig. 1 Clinical symptoms of diseased tadpoles of Rana nigromaculata箭头所示位置可见腹部肿胀,体表多处出血The arrowhead areas show swollen abdomen and hemorrhage on body surface
患病蝌蚪肝脏与腹水的组织涂片,经革兰染色后镜检未观察到细菌,且划线接种的BHI琼脂平板,在28 ℃培养48 h后未发现细菌生长。
2.2 组织病理学检查
组织病理检查发现黑斑蛙患病蝌蚪肝脏、肾脏、脾脏、胰腺等组织均发生明显变性、坏死变化,且一些病变的细胞胞浆内见嗜碱性包涵体()。肝细胞肿胀,灶性坏死,一定量淋巴细胞浸润,在部分病变的细胞浆内见嗜碱性包涵体();脾脏淋巴细胞坏死,实质内出现大量核碎片,脾实质内淋巴细胞数量明显减少();胰腺上皮内酶原颗粒减少,胰腺灶性坏死();肾间造血组织坏死,细胞核表现为浓缩、裂解与溶解消失,肾小球坏死(),肾小管上皮细胞变性,甚至坏死,固有结构消失。
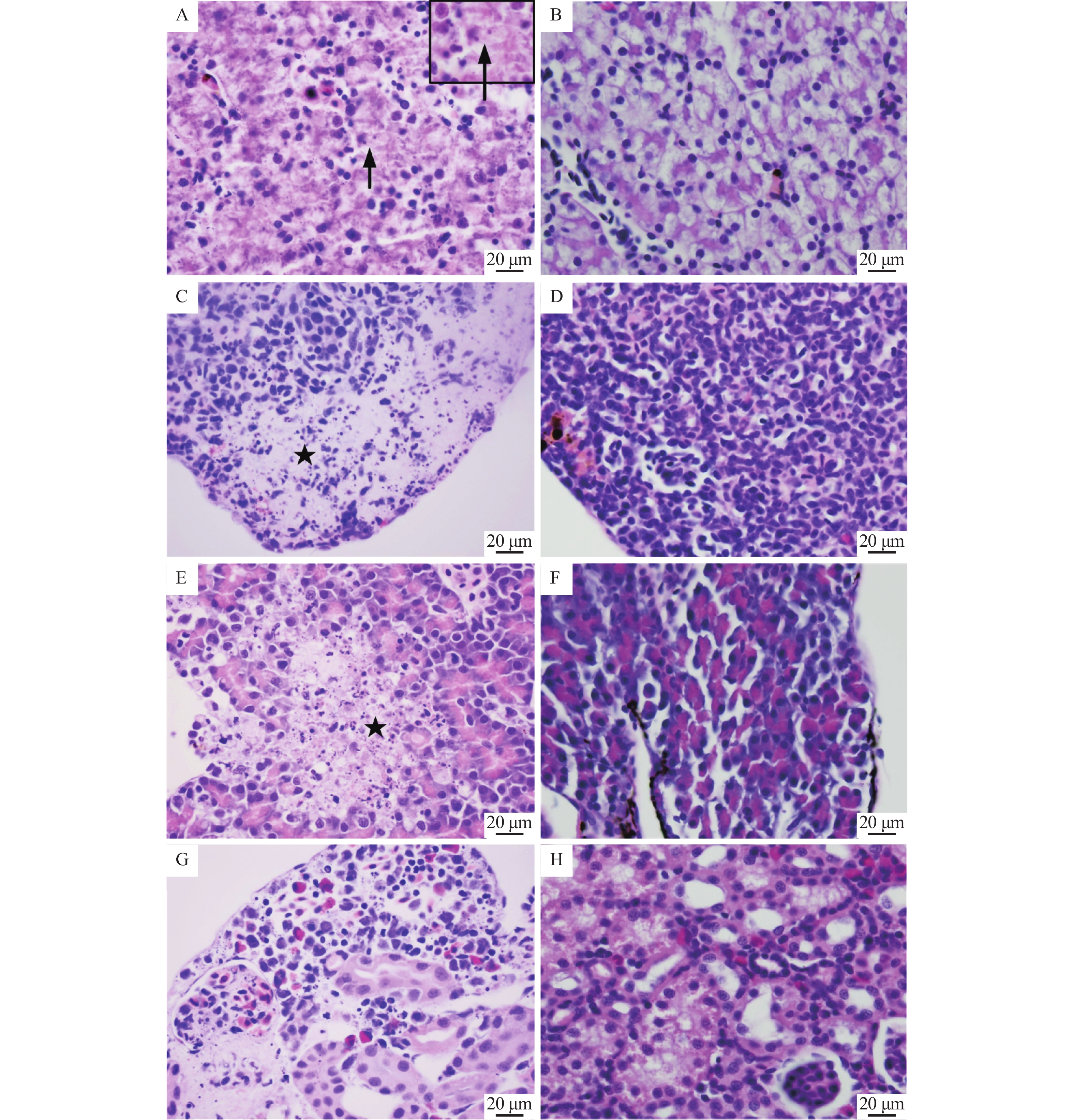
图 2 黑斑蛙患病蝌蚪的组织病理学损伤Fig. 2 Histopathological lesions of diseased tadpoles of Rana nigromaculataA:肝细胞灶性坏死,胞浆内见嗜碱性包涵体(→);C:脾淋巴细胞坏死,数量明显减少(★);E:胰腺灶性坏死(★);G:肾小球坏死,肾间造血组织坏死;B、D、F和H分别为健康蝌蚪的肝、脾、胰腺和肾组织A: Focal necrosis in hepatocytes, basophilic inclusions in intracytoplasm (→); C: Lymphocytes necrosis and reduction in spleen (★); E: Focal necrosis in pancreas (★); G: Necrosis of glomerulus and interrenal hematopoietic tissue; B, D, F and H are liver, spleen, prancreas and kindey tissues of healthy tadpoles respectively
2.3 病毒分离
黑斑蛙患病蝌蚪组织匀浆液接种EPC细胞后,连续盲传3代都出现稳定明显CPE现象,感染初期细胞边缘皱缩、变圆变亮,然后逐渐脱落,形成大量空斑,接种4 d后对照组细胞生长正常(),而EPC细胞单层呈明显破渔网状()。分离病毒暂命名为黑斑蛙蛙病毒(R. nigromaculata ranavirus,RNRV),按照Reed-Muech法测定其在25 ℃条件下接种EPC细胞产生80% CPE时TCID50为108 mL–1。
图 3 黑斑蛙患病蝌蚪组织匀浆液感染EPC引起的细胞病变Fig. 3 CPE produced by inoculation of EPC cells with tissue filtrate from diseased tadpoles of Rana nigromaculataA:对照组细胞;B:接种病毒4 d后细胞A:Control cells;B:Cells four days after virus infection
2.4 人工感染试验
试验蝌蚪浸泡感染3 d后出现食欲减退,游动缓慢现象,5 d后开始出现死亡,第7—14天为死亡高峰期,此时累计死亡15尾,随后感染蝌蚪死亡趋于缓和,直至人工感染21 d后,共死亡16尾,累计死亡率80%,对照组全部存活无异常()。试验组感染蝌蚪发病症状与自然患病蝌蚪临床表现相似,腹部肿胀明显,剖检腹腔内有淡黄色腹水,肝肿大充血,肠腔内充有大量黏液。
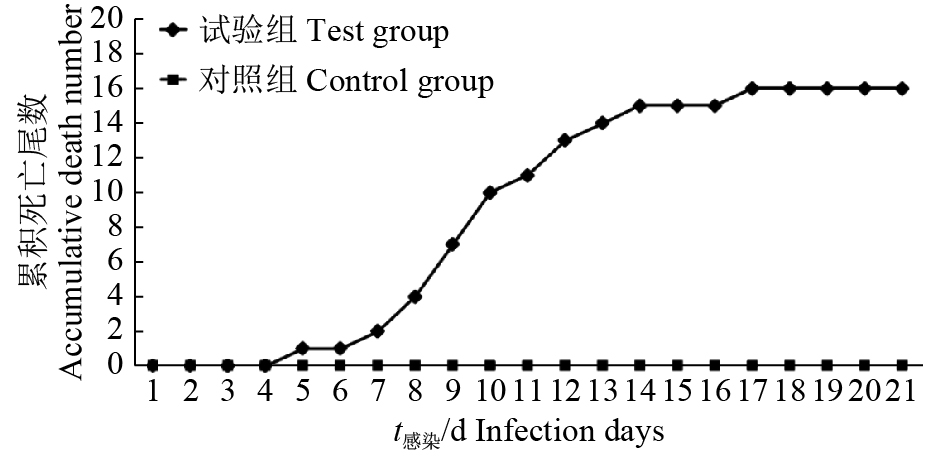
图 4 人工感染试验结果Fig. 4 Result of artificial infection experiment
2.5 电镜观察
对接种病毒并出现CPE的EPC细胞进行超薄电镜切片观察,可见大量正六边形、有囊膜,对角线直径为(135±8) nm ()的病毒颗粒。胞浆内的病毒粒子规则排列呈晶格状结构(),成熟的病毒颗粒以出芽的方式通过细胞膜被释放到细胞外(),病毒的复制与释放使细胞受损,细胞质严重空泡化()。根据以上病毒形态学特征,初步推断该病毒为虹彩病毒样病毒。
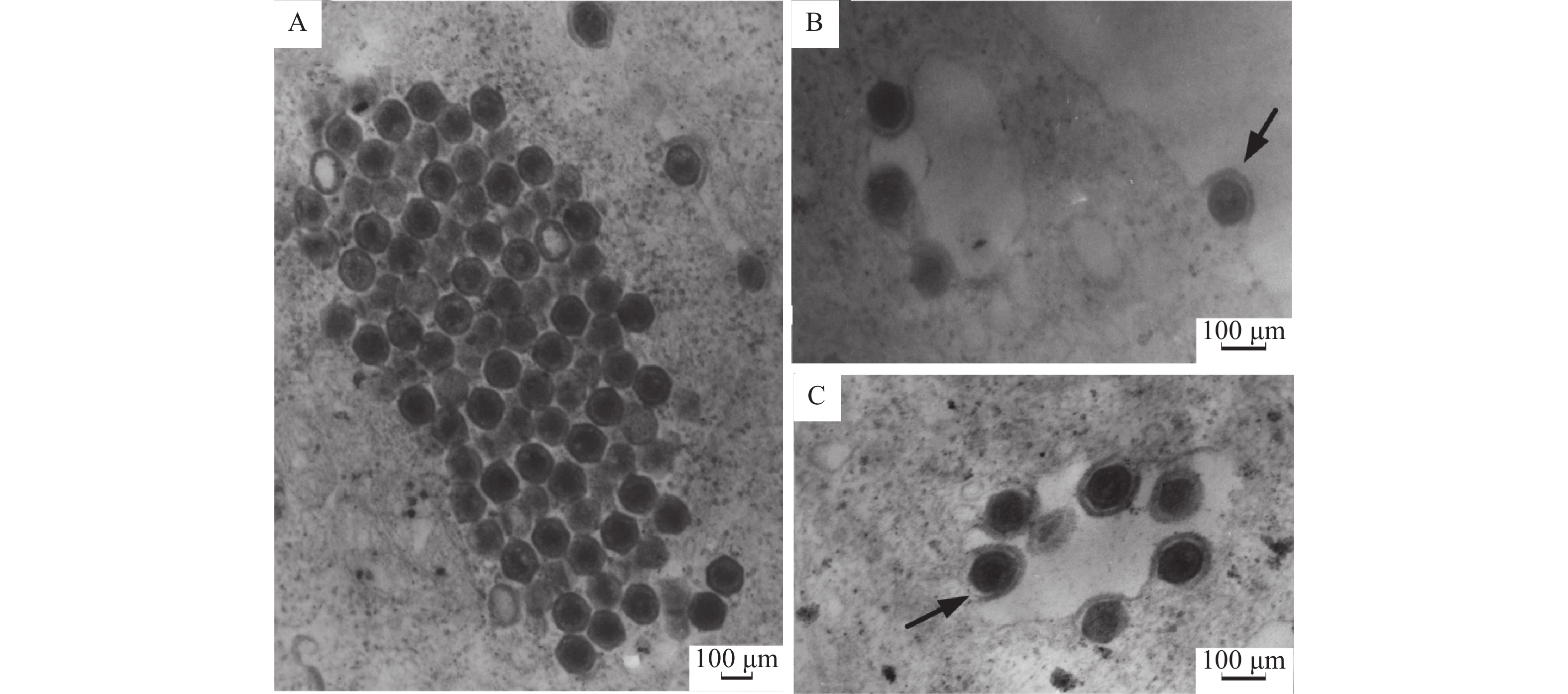
图 5 电镜观察感染EPC细胞的虹彩病毒样粒子Fig. 5 Electron micrograph of the iridovirus-like particles infecting EPC cellsA:排列成晶格状的虹彩病毒样粒子;B:病毒以出芽方式从细胞膜释放并获得外膜(→);C:细胞质空泡内可见病毒粒子(→)A: Iridovirus-like particles arrayed in crystalline;B: Virion is budding through the cell membrane to obtain envelope (→);C: Virus particle in the cytoplasmic vacuole
2.6 MCP基因的PCR检测
针对蛙病毒部分MCP基因进行PCR扩增,结果显示自然患病蝌蚪、已分离的病毒液以及自然患病蝌蚪饲养水源样本在琼脂糖凝胶中均检测到约500 bp的清晰条带,与预期目的片段大小基本一致()。将扩增条带测序结果在GeneBank上进行比对,发现该序列与已知蛙病毒属病毒如FV3(KJ175144、FJ459783)、甲鱼虹彩病毒(Soft-shelled turtle iridovirus,STIV,EU627010、GQ144408)、RGV(JQ654586、KY264205)的MCP基因具有高达99%的相似性,由此可证明该病毒为虹彩病毒科蛙病毒属成员。
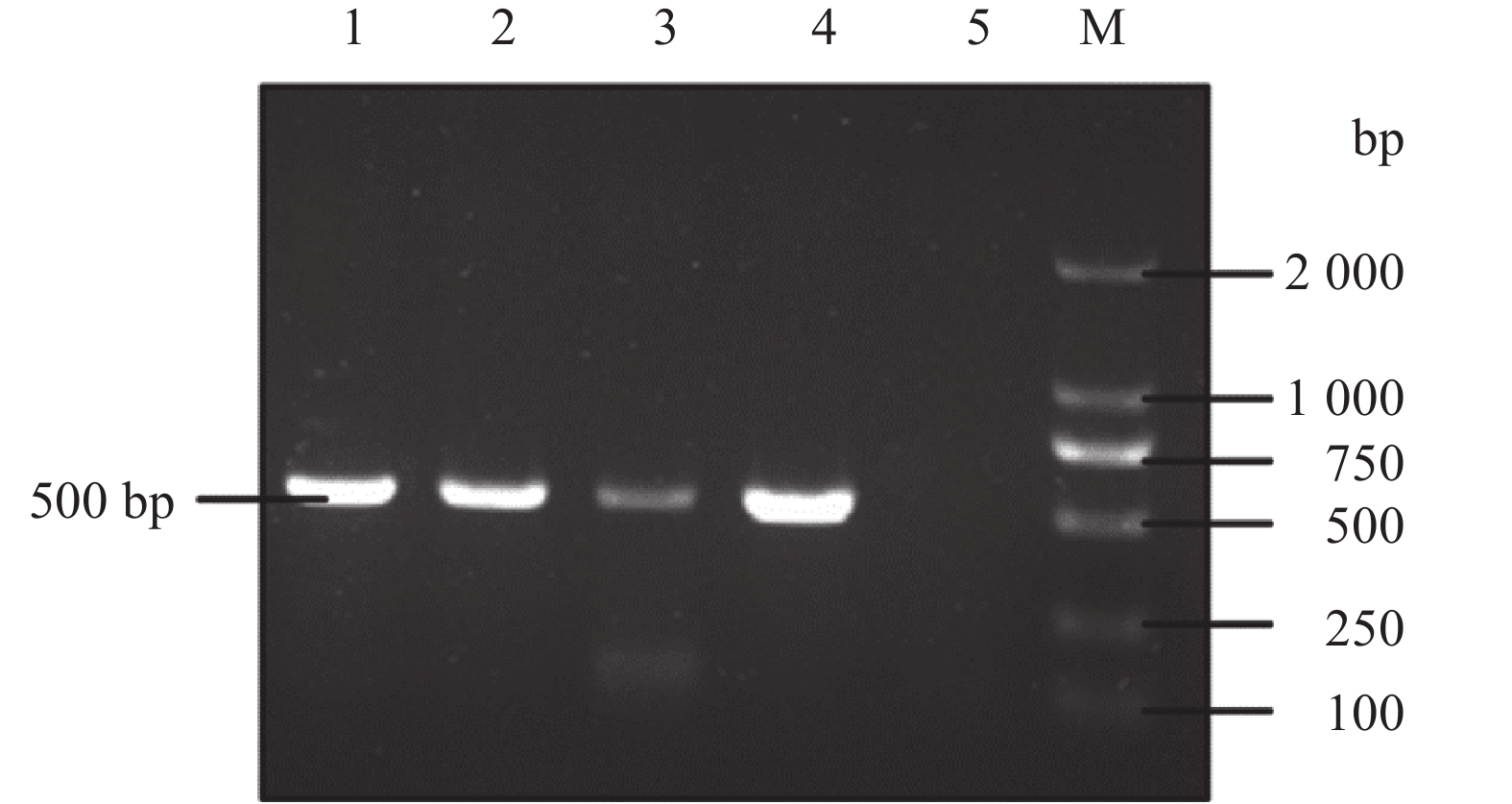
图 6 部分MCP基因的PCR检测结果Fig. 6 Electrophoresis of PCR-product of partial MCP genesM:DL2000 DNA Marker;1:自然患病蝌蚪组织;2:分离病毒液;3:水源样本;4:阳性对照;5:阴性对照M: DL2000 DNA Marker; 1: Tissue sample of diseased tadple; 2: Isolated virus fluid; 3: Water sample; 4: Positive control; 5: Negative control
2.7 MCP基因克隆测序及系统发育分析
采用扩增蛙病毒MCP基因全序列的引物PCR扩增获得预期目的片段,对该扩增产物纯化后测序,基因全长1 392 bp,其GenBank登录号为MF359927。对该序列与其他14种已分离虹彩病毒的MCP基因构建系统发育树,结果发现该分离株归为蛙病毒属FV3病毒类群(),且在进化关系上与同样分离自中国的RGV和STIV的亲缘关系最近。
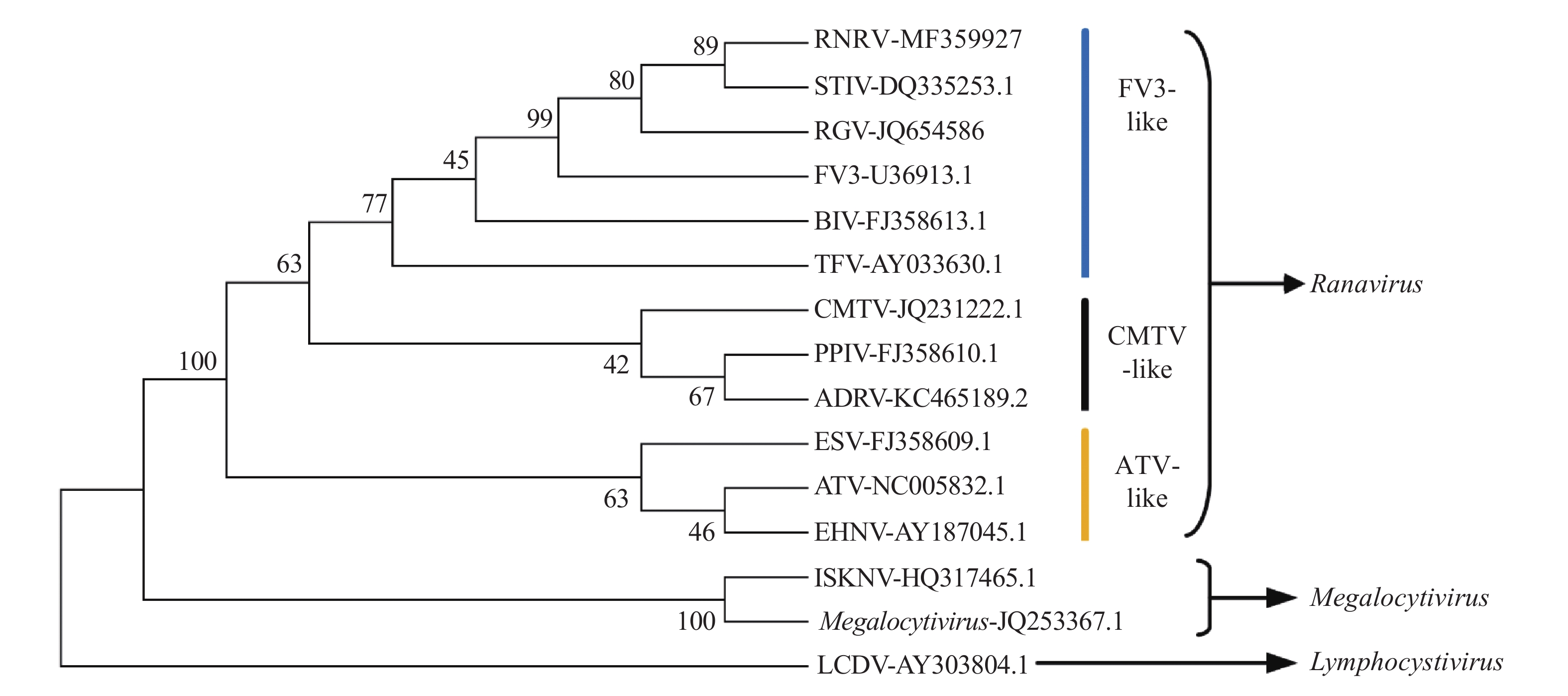
图 7 基于MCP基因序列的不同虹彩病毒株的系统发育树Fig. 7 Phylogenetic tree of different ranavirus strains based on MCP gene sequences
3 讨论与结论
自20世纪80年代以来,关于蛙病毒感染各类物种种群的报道屡见不鲜,其中不乏在生物保护与国际贸易上具有重要价值的鱼类、爬行类和两栖类,这些动物种群数量的大量下降与蛙病毒感染的密切联系引发了全球性的关注[]。对于近30年蛙病毒感染的全球的出现的原因到底是病毒毒性的增强或是病毒的传播能力提高(通过自然或与人类相关的活动),又或是诊断和检测能力的提升呢?现在还没有定论。但不论如何,蛙病毒如今已被认为是一种能够感染多种变温脊椎动物(鱼类、爬行类、两栖类)的病原体,并引发很高发病率与死亡率。
本研究发现RNRV感染黑斑蛙蝌蚪具有发病迅速、死亡率高的特点,患病蝌蚪腹部肿胀,下颌与腹部等体表出血,剖检见腹腔内有淡黄色腹水,肝肿大充血,肠道空虚且腔内充有大量黏液。对患病组织进行病理切片观察,发现其肝、脾、肾、胰腺组织中均显示有明显的变性和坏死病灶,同时在部分病变的细胞胞浆内见嗜碱性包涵体。这些临床特征与组织病理学变化表明了RNRV对宿主多器官的损伤与系统性的感染,与其他蛙类感染蛙病毒的症状与病理变化基本一致[]。刘丹等[]和Cheng等[]报道肝、脾、肾是蛙病毒在感染两栖类或其他动物时主要靶器官,其造血组织、血管内皮细胞和上皮细胞的出血、坏死,以及胞浆内含有嗜碱性包涵体是常见的微观变化。此外通过对RNRV病毒粒子的电镜观察与病毒基因的特异性PCR检测,其形态学特征与其他蛙病毒属病毒高度相似,其MCP基因的进化分类结果也显示该病毒归为蛙病毒属,且与FV3病毒类群具有更为紧密的进化关系,因此综合判断该病毒为虹彩病毒科蛙病毒属成员。
在此次事件中,发病蝌蚪是从广东省购回的种蛙产卵孵化而来,在蝌蚪发病期间,种蛙未出现任何死亡。对蛙病毒的特异性PCR检测结果显示,种蛙和蛙卵样本均呈阴性,而水源样本却呈蛙病毒阳性。根据现场调查,养殖场蝌蚪饲养水源来自未经任何处理的河水,而河的上游同样有几个蛙类养殖场。因此,本次养殖黑斑蛙蝌蚪大规模死亡的原因可能是由水源中的蛙病毒通过水平传播感染蝌蚪所致。有报道称,蛙病毒具有很强的环境适应能力,它能长时间的潜伏于不敏感宿主或池塘基质中,通过水的传播持续对环境中存在的敏感宿主造成威胁[-],在养殖过程中蝌蚪由于环境应激或发育等因素导致自身免疫水平低从而引起感染致病;同时蝌蚪具有同类相食的习性,濒死或死亡蝌蚪往往会引起同类的撕咬分食,而致病毒在种群中传播[-]。由此可见,在养殖过程中对水源的消毒处理以及及时清除与无害化处理病死动物在防止蛙病毒的发生与传播中具有重要的意义。
主要衣壳蛋白是蛙病毒属病毒主要的结构蛋白,其基因序列的高度保守性使其常用于对不同株的蛙病毒的区分以及进化关系的分析。本研究通过对RNRV MCP基因的序列比对发现其与RGV、FV3、STIV等其他蛙病毒属成员相似度达99%以上,且以MCP基因构建系统发育树结果显示其与以上几种蛙病毒都归属于蛙病毒中的FV3病毒类群。RGV、STIV以及此次分离的RNRV都分离自我国的两栖类,其中RGV是最早于1996年分离自美国进口的沼泽绿牛蛙,也是我国第1株报道的蛙病毒,本研究中发现RNRV与它在进化关系上具有较近的亲缘关系,因此,对于RNRV是否是由RGV进化而来值得进一步的研究。
