鸭坦布苏病毒(duck Tembusu virus,DTMUV)是黄病毒科黄病毒属恩塔亚病毒群的一种新型黄病毒,可引起雏鸭腹泻和神经症状,蛋鸭卵巢出血坏死、产蛋量急剧下降,严重者出现死亡的急性高度接触性传染病[-]。2010年,鸭坦布苏病毒病在我国福建、浙江、江苏等地区的蛋种鸭中首次暴发,以种鸭和蛋鸭易感性最高。目前,该病的感染宿主已扩大至肉鸭、番鸭、鹅、蛋鸡、鸽子、麻雀等多种禽类,给我国养鸭业造成了巨大的经济损失,严重威胁养禽业健康发展[-]。
自2014年后,我国陆续研制出了DTMUV弱毒疫苗、灭活疫苗等多种疫苗,商业化疫苗的广泛使用让我国鸭坦布苏病毒病发病率急剧下降,仅呈现散发状态[, ]。然而,参与病毒吸附、侵入和宿主特异性免疫反应等重要过程的抗原蛋白(E蛋白)发生重要变异,进而引发免疫失败或疫苗保护率下降,致使DTMUV的防控难度增加[]。此外,DTMUV还可在小鼠体内复制,具有高度的神经毒性和与年龄相关的神经侵袭性,并且对人神经和肝细胞系也高度敏感,具有潜在的人兽共患风险,因此,对DTMUV进行深入研究具有重要意义[-]。本文结合DTMUV的分子生物学特征、流行现状、天然抗病毒的分子机制以及疾病诊断的研究进展进行综述,以期为该病原的基础研究和诊断防控提供参考。
1 DTMUV分子生物学特征
DTMUV属于黄病毒科黄病毒属恩塔亚病毒群的成员,为有囊膜单股正链线性的RNA病毒,呈二十面体对称,具有典型的黄病毒形态。病毒基因组全长约11 kb,只包含一个开放阅读框(open reading frame,ORF)编码多聚蛋白前体,该蛋白前体可由病毒蛋白酶和宿主蛋白酶剪切成3个结构蛋白(核衣壳蛋白C、前膜蛋白prM和囊膜蛋白E)和7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5),基因组结构为5′-UTR-C-prM-E- NS1-NS2A-NS2B-NS3-NS4A-2K-NS4B-NS5-UTR-3′()[]。黄病毒通常以帽子依赖的方式翻译,而登革病毒、寨卡病毒、乙脑病毒、坦布苏病毒可以通过不依赖帽子的方式在哺乳动物、鸟类和蚊子细胞中翻译。抑制非帽子依赖性翻译的突变降低了DTMUV的增殖,延迟了受感染鸭胚的死亡,但不能阻止死亡[]。因此,DTMUV的5′UTR和3′UTR使病毒能够使用不依赖于帽子和内部核糖体进入位点(internal ribosome entry site,IRES)的RNA基因组翻译策略,这不仅可以逃避宿主翻译中断,还可用于生产黄病毒的减毒变异体作为潜在的候选疫苗。核衣壳蛋白C能与病毒基因组相互结合组装成核衣壳,保护基因组免受RNA酶降解。prM是M蛋白的前体蛋白,成熟的M蛋白嵌合在病毒囊膜的脂质双分子层中,对维持E蛋白的空间构象十分重要[]。E蛋白是DTMUV最大的结构蛋白,参与病毒吸附、侵入和宿主特异性免疫反应等重要过程,与不同毒株间的毒力差异密切相关[-]。E蛋白经过不同程度的空间折叠可以形成特殊的空间结构,可以分为3个区域:中央结构域、强亲水结构域和C末端结构域。中央结构域在强亲水结构域和C末端结构域之间起到连接两个结构域的桥梁作用;强亲水结构域主要参与E蛋白二聚体的形成过程;而C末端结构域的主要作用是介导病毒与宿主细胞受体的结合从而促进病毒进入细胞。同时,该蛋白有多个能诱导机体产生特异性中和抗体的病毒毒力决定簇,可以引发保护性免疫应答,广泛应用于疫苗研究中,是疫苗研制的潜力蛋白[-]。
图 1(Fig. 1)
Fig. 1

图 1 鸭坦布苏病毒基因组结构示意图 Fig. 1The schematic diagram of genome structure of DTMUV
非结构蛋白与结构蛋白紧邻,主要在病毒入侵、复制和翻译过程发挥重要作用,但许多功能及其作用机制依然未知。非结构蛋白NS1属于高保守性的分泌型糖蛋白,依靠其可溶性补体结合活性诱导产生非中和性抗体,并且与病毒复制、抗病毒感染、免疫调节作用相关[]。NS2A和NS2B均为疏水性蛋白,其可以相互作用构成病毒的主要蛋白酶,对病毒多聚蛋白进行剪切和加工[]。NS3具有丝氨酸蛋白酶、核苷酸三磷酸酶和RNA解旋酶活性,可参与病毒RNA的复制,改变病毒与宿主的相互作用。研究显示,NS3的HELICc结构域与PRDX1结合,调节p38/丝裂原活化蛋白激酶通路,使病毒逃避宿主免疫反应[]。NS4A和NS4B在病毒复制和病毒-宿主相互作用中起多种作用,NS4A与NS3、NS4B与NS5形成的蛋白复合体,抑制宿主细胞产生的抗病毒反应。NS5为黄病毒分子量最大、最保守的蛋白,含有甲基转移酶和RNA依赖的RNA聚合酶活性,可抑制干扰素和IL-8的表达。根据其保守性和在病毒复制过程中的重要功能,可用于开发诊断和治疗方法[-]。
2 DTMUV的流行现状
1955年,在马来西亚的三带喙库蚊中首次分离出坦布苏病毒原型毒株MM1775。2007年,在泰国观察到一种与鸭严重神经症状和产蛋损失有关的严重传染病,病原为DTMUV[-]。2013—2014年,泰国多家农场发生了DTMUV疫情,平均感染率为17.19%,死亡率为10%~30%[]。1995年,我国河北地区发生鸭繁殖障碍和神经系统失调的疫病,直至1997年才分离到DTMUV毒株。2010年以来,DTMUV以高感染率(高达90%)和较高死亡率(5%~30%)为特征,在我国各养鸭场大面积暴发[-]。该病首先发现于浙江,随后蔓延至沿海13个省市的主要养鸭地区,以雏鸭生长迟缓、厌食和死亡,蛋鸭产蛋下降、腹泻且排绿色粪便为基本临床特征,病程长达数周,可继发大肠杆菌感染,是严重危害我国养鸭业的核心传染病[]。DTMUV对7周龄以下的雏鸭具有较强致病性,其中雏鸭感染日龄对疾病严重程度有很大影响[]。DTMUV感染1~9日龄北京鸭后导致18%~100%的死亡率;而感染2~7周龄北京鸭,不同毒株所导致的严重程度不一,但无死亡发生。此外,研究发现,DK/TH/CU-1毒株感染4周龄鸭只,出现了22.86%的死亡率。
蛋鸭感染后2 d出现厌食,3~4 d出现产蛋急剧下降,甚至绝产,并伴有绿色粪便,其中新开产鸭群表现最为严重。Yang等[]通过建立雏鸭TMUV感染模型,证实TMUV进入中枢神经系统后在脑微血管内皮细胞内存活和增殖引起脑炎,最终破坏血脑屏障。肉鹅感染TMUV的发病日龄在40~60日龄,表现为拉绿色稀便,翅和双脚麻痹,死淘率约10%。然而在2019年3月,我国东北地区的金定鸭群出现以翻个、脚软、排绿色稀粪为特征的DTMUV感染病例,无明显的细菌感染,2~4周龄鸭死亡率高达40%,5~6周龄鸭的死亡率高达25%,7~8周龄鸭的死亡率低于10%[, , ]。通过致病性试验分析发现,DTMUV H毒株(2.1亚群)比Y毒株(2.2亚群)对3周龄雏鸭的致病性更强[]。最新的一项研究发现,TMUV病毒的E蛋白T367K突变在病毒细胞适应和毒力衰减中起着主导作用,并且NS1在遗传进化上为病毒的高变区,其是否为影响病毒临床症状的改变因素需要进一步研究[, , ]。根据DTMUV ORF核苷酸的遗传进化关系可分为3个群,中国主要流行2.1亚群、2.2亚群和3亚群,泰国和马来西亚等地区主要流行1亚群和2.1亚群[]。
通过地理系统分析表明,坦布苏病毒可能是从马来西亚、泰国等东南亚国家向中国华南地区扩散,并进一步向山东等北方地区扩散。通过病毒监测发现,在鸽子和野鸭等野生鸟类中检测出TMUV,而东亚-澳大利亚飞行通道是世界上候鸟的主要飞行通道之一,该飞行通道经过许多国家,包括马来西亚、泰国和中国等。因此,TMUV的传播可能通过该飞行通道的候鸟传播,还需要对候鸟感染TMUV的流行病学进行进一步的研究来确定[]。近几年来,鸭坦布苏病毒病在我国各地此起彼伏,时有发生,并且不断有DTMUV感染种鸡、蛋鸡和鹅等禽类的报道。在自然条件下,DTMUV可通过库蚊作为媒介传播病毒,是该病表现出明显季节性的重要原因[]。但通过长期的监测发现,该病在一年四季均可发生,在秋冬季节依然出现流行,说明其还可通过其他的传播途径感染。鸟类尤其是家禽是DTMUV的储存宿主,在传播过程中可能起着非常重要的作用[]。此外,粪口传播、空气传播和垂直传播也是该病的主要传播方式[-]。
3 DTMUV与宿主天然免疫应答3.1 先天免疫应答
宿主的天然免疫是抵御病原体入侵的第一道防线,在早期抵御病毒感染中发挥重要作用。模式识别受体(pattern recognition receptor,PRRs)是先天免疫系统的重要组成部分,可以识别病原体,激活特定的信号级联,诱导Ⅰ型干扰素(IFN-Ⅰ)和促炎性细胞因子的产生,最终导致先天免疫的建立和获得性免疫的发展。在天然免疫的主要四大信号通路中,其模式识别受体(PRRs)主要包括Toll样受体(TLRs)、RIG-I样受体(RLRs)、NOD样受体(NLRs)和DNA受体(AIM2、cGAS、DAI)等。不同的PRRs定位在细胞不同位置:TLRs主要镶嵌在细胞表面或细胞内双层膜结构中;RLRs主要定位在细胞质,它们特异性地识别相应病原微生物PAMPs分子;DNA受体主要定位在细胞质,识别胞质中的dsDNA结构,是一组I型跨膜蛋白,感知不同的入侵病原体在细胞膜外以及内体和溶酶体内的情况。在鸭中的TLRs包括TLR2、TLR3、TLR4、TLR5和TLR7,可以感知细胞膜外的病原体及内吞小体内的病毒和微生物体基因组。DTMUV感染鸭胚成纤维细胞,TLR5和TLR3转录水平显著上调,而TLR7的表达水平出现下调。
激活的TLR3和TLR7募集接头蛋白,分别诱导TRAF6和MyD88,TRAF6与RIP1、TAK1结合蛋白2、TAK1结合蛋白3、NEMO等形成的复合物,MyD88通过下游分子IRF-1诱导Ⅰ型干扰素的产生,抵御DTMUV的感染()[-]。体内试验结果显示,DTMUV感染大脑和脾后2 h,TLR3表达量分别增加了28.54倍和1.57倍[]。以上结果都表明,TLR3介导的信号通路是抑制DTMUV复制所必需的。RLR家族的3个成员RIG-I、MDA5和LGP2可在大多数的组织中表达,其作为细胞质的受体能够感应并识别各种不同病毒的RNA,并激发下游信号通路,诱导Ⅰ型干扰素产生和抗病毒基因表达。通过试验发现,RIG-I和MDA5参与了宿主对DTMUV的天然免疫应答[-]。通过研究证实,MAVS的过表达显著降低了DTMUV的复制,而其敲除增加了DEF细胞中的病毒滴度,并且显著降低了DTMUV诱导的IRF1、NF-κB和IFN-β的激活[]。此外,利用LC-MS/MS对DTMUV感染鸭的卵泡蛋白质组进行定量分析表明,RLR信号通路参与了DTMUV感染,在感染DTMUV的雏鹅中,RIG-I、MDA5、LGP2和干扰素基因刺激物(STING)在感染后5 d都显著增加[]。
除了TLR和RLR外,其他PRRs包括NOD样受体、胞浆DNA受体在应对微生物感染方面也起着至关重要的作用。研究发现,DDX3X和DDX5在DTMUV感染的BHK21细胞中显著减少,其中,DDX3X过表达通过TBK1蛋白调控IFN-Ⅰ抑制DTMUV的增殖,其结果与在其他哺乳动物细胞中检测到的DDX5不同,表明鸟类和哺乳动物对DTMUV的先天免疫应答可能存在差异[]。虽然DTMUV感染可能涉及多种PRRs,但目前仅关注这些PRRs的表达变化,其具体功能有待进一步研究。
图 2(Fig. 2)
Fig. 2
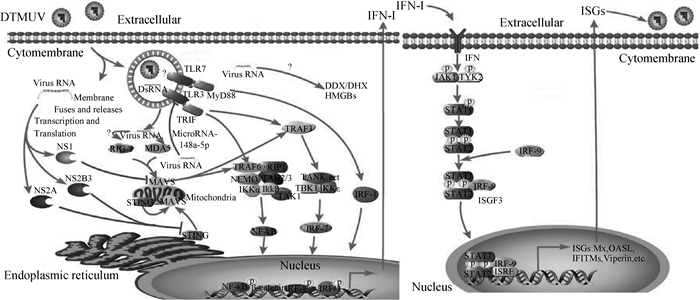
图 2 DTMUV感染和病毒逃逸机制介导的先天免疫应答模式图[] Fig. 2Innate immune response mediated against DTMUV infection and viral evasion mechanisms
3.2 免疫逃避
在感染早期,真核生物依赖PRRs识别PAMPs到最终产生IFN-Ⅰ来抵御病原微生物入侵。研究已经证实了DTMUV进化出多种策略阻断IFN-Ⅰ产生过程中的信号传递,包括阻断病原的识别、操纵信号通路的关键分子、调控IFN-Ⅰ基因转录和翻译等()。MDA5和TLR3依赖的信号通路诱导IFN-Ⅰ的表达,对抵御病毒的复制具有重要作用。DTMUV感染DEF细胞外分泌体中的miR-148a-5p可以靶向TLR3,下调IFN-β的表达,从而逃避宿主的天然免疫应答[]。研究还发现,DTMUV感染DEF细胞导致miR-148a-5p的下调,进而导致SOCS1表达的上调;同时,miR-221-3p的表达水平也出现上调,促使SOCS5表达的下调,两种途径均可抑制IFN-β的表达使病毒逃避宿主的免疫应答反应[]。DTMUV的蛋白通过不同的策略抑制IFN产生,也是病毒逃逸宿主免疫反应的重要途径。DTMUV的NS1蛋白靶向MAVS,阻断RIG-I/MDA5和MAVS的结合,显著抑制病毒触发的IFN-β的表达[]。NS1蛋白的表达导致RPS7和MDM2的低表达,最终导致p53的高表达[]。p53已被报道是抵抗大多数病毒(包括HIV-1、HCV、PEDV、FMDV和NDV等)复制的重要宿主限制因子,通过影响宿主细胞的周期阻滞、DNA修复、自噬、衰老和凋亡促进病毒的感染,而p53的高表达对DTMUV复制的影响通路还有待进一步验证。DTMUV NS2A以剂量依赖的方式显著抑制RIG-I、MDA5、MAVS、STING、TBK1诱导的IFN-β的转录,促进病毒的感染。NS2A与TBK1竞争结合STING,破坏依赖于STING的抗病毒细胞防御,为DTMUV抵御宿主天然免疫反应的一种新的机制[]。
4 DTMUV的诊断与防控
病毒分离与鉴定是诊断病毒性疾病的金标准,可利用病鸭的卵巢、脾及脑等组织,经研磨、离心、过滤后接种鸡胚/鸭胚,亦可用DEF、CEF、BHK-21、DF-1和Vero等细胞系进行病毒的分离鉴定,其中,BHK-21细胞对DTMUV的分离率最高[]。但该方法对于研究人员的操作技术要求较高,且成功率相对较低。自DTMUV暴发以来,已开发了大量病原学(RT-PCR、RT-qPCR、RT-LAMP及高通量测序等)[, -]和血清学(ELISA、胶体金免疫层析及中和试验等)[-]的检测方法,其中,RT-PCR为最广泛的病原检测方法,适用于流行病学调查和临床诊断。SHERLOCK是Zhang团队基于Cas13a非特异RNA切割系统开发的一种快速、廉价、高灵敏度的新核酸诊断技术,以此开发的DTMUV检测方法具有极大的应用前景[]。
自2010年DTMUV在我国暴发以来,已成为养鸭业的重要疾病,给养鸭业带来了巨大的经济损失。疫病防治的核心为“防重于治”,需从生物安全防控、饲养管理及养殖方式等多方面采取合理的防控措施控制疫病的传播与扩散。目前,疫苗免疫是DTMUV最重要的防控方式之一,研发的灭活疫苗、弱毒疫苗和基因工程疫苗均取得了良好的预防效果。DTMUV弱毒株的制备主要依靠细胞或禽胚上连续传代致弱和使病毒毒力基因突变或者重组的基因工程方法。将DTMUV分离株FX2010在CEF细胞中连续传代至P180,致弱毒株接种鸭群后能诱导良好的免疫应答,且能完全抵抗强毒株的攻击,并已开发成为商品化弱毒苗[]。而He等[]使用从麻雀中分离到的DTMUV强毒株在SPF鸡和鸭胚胎中交替传代连续传代至第70代,致弱毒株免疫雏鸭后具有极好的免疫原性和安全性,对DTMUV强毒株感染的保护率为100%。在灭活疫苗中添加IL-2比未添加的灭活疫苗可显著增强机体的体液和细胞应答,诱导的抗体水平更高,同时减少了接种抗原的剂量,可有效解决接种量大、免疫周期短、效果不完全等局限性[]。DTMUV基因工程疫苗的研究主要集中在重组抗原疫苗、重组载体疫苗及DNA疫苗。
研究发现,DTMUV E蛋白的Ⅰ、Ⅱ和Ⅲ结构域均能诱导小鼠产生抗体,利用杆状病毒表达系统构建的截短的E蛋白能诱导雏鸭产生特异性抗体反应,可抵抗DTMUV感染[-]。基因重组载体疫苗具有安全性高、免疫原性好等特点。有学者利用重组腺病毒和沙门菌作为载体开发DTMUV重组载体疫苗,可刺激机体产生较高水平的细胞免疫应答,并产生高水平的中和抗体,产生100%的攻毒保护作用[]。DNA疫苗也是DTMUV疫苗研究的热点,雏鸭肌肉注射基于SFV复制子和DTMUV E蛋白的DNA疫苗后,所有免疫的雏鸭都产生了强烈的体液和细胞免疫反应,并能抵抗DTMUV AH-F10强毒株的攻击,为新型疫苗的开发提供了新的思路[]。衣壳蛋白靶向灭活(CTVI)是一种概念上强大的新型抗病毒策略,它基于病毒衣壳蛋白与核酸酶的融合蛋白装配到病毒粒子中,以破坏病毒DNA/RNA或干扰病毒关键蛋白的正确折叠。利用该策略发现,DTMUV衣壳融合蛋白可以在敏感的BHK21细胞中表达而不产生细胞毒性,并且具有良好的钙依赖核酸酶活性,可抑制TMUV的复制[]。目前无特效的抗病毒药物来对抗DTMUV感染,而利用降解病毒基因组是一种新的抗DTMUV基因疗法。
有学者基于DTMUV NS5基因构建了重组腺病毒载体,其高效地抑制了DTMUV的增殖,并对病毒的抑制作用呈剂量依赖性[]。最新研究发现,Cas13b是一种利用RNA引导靶向和切割RNA分子的CRISPR酶,具有高度的特异性和靶向灵活性,已有报道在哺乳动物和植物细胞中抑制RNA病毒,可能在未来的抗RNA病毒治疗中发挥积极的作用[-]。利用CRISPR/Cas13b系统构建了靶向PRRSV ORF5和ORF7基因的重组载体,在转基因Marc-145细胞中显示出很强的抑制效果,同时针对ORF5和ORF7基因的双crRNA几乎完全消除了病毒感染[],在基孔肯雅病毒的研究中也显示出强大的抑制病毒增殖效果[]。
5 展望
自鸭坦布苏病毒病疫苗上市以来,病毒的流行和传播得到了有效的控制,但在全国主要的养鸭地区仍出现零星散发的情况。DTMUV基因组极易发生变异,在易感动物的免疫压力下发生重组变异,其对病毒的免疫原性、致病性和宿主感染谱均可能发生不同程度的改变。通过对DTMUV毒株全基因组测序分析发现,临床上出现多株新的变异毒株,而现行的TMUV弱毒疫苗/灭活苗对变异毒株是否具有免疫保护力还未可知,需要进一步的研究。因此,对DTMUV长期进行流行病学调查及遗传变异分析,为有效、快速地对DTMUV进行防控极其重要。迄今为止,虽然人们对于DTMUV的病原学、流行特点及宿主天然免疫的分子机制进行了研究,但对病毒吸附受体作用详细机理、不同组织中复制作用的变化情况、抗体干扰病毒的分子作用模式及其他影响机体免疫力的模式尚不完全清楚。此外,研究DTMUV的潜在宿主,彻底消灭潜伏的带毒感染源,仍是人们所面对的难题,有待进一步研究。
