通讯单位:美国密西根大学医学院
材料与方法
实验设计
采用Taconic Biosciences (Tac)和Jackson Laboratories (Jax)两家实验室小鼠供应商的小鼠,以Jax和Tac亲鼠的微生物群落作为基准来确定亲代和后代之间群落结构的相似性。在同笼实验中,年龄相同的Jax和Tac雌鼠在断奶时(21天)同笼(最多6只/笼),直到第7周。非同笼的雄性和雌性同胞作为sentinel对照(Jax和Tac均为3只/笼),此外确保同笼和非同笼的小鼠来自同一亲鼠。
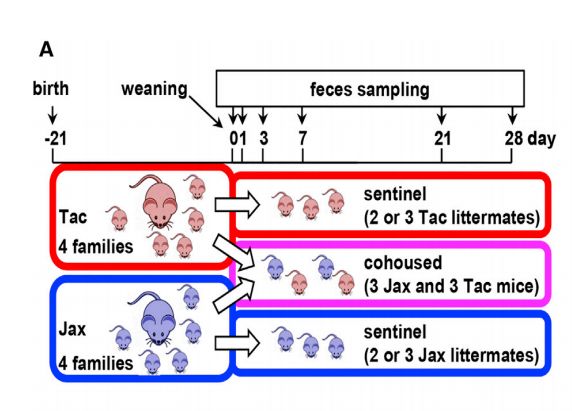
实验设计示意图
本实验共使用26只雌性(14只Jax和12只Tac)和17只雄性(9只Jax和8只Tac)小鼠。分别于断奶(第0天)、同笼后第1、3、7、21和28天收集粪便样本。另外,收集sentinel对照小鼠和每只亲鼠的粪便颗粒。该实验进行了四次(4个不同的小鼠家族),以验证重现性。
测序区域及平台
Illumina MiSeq;16S rRNA V4区
研究成果
1、Jax和Tac小鼠粪便微生物菌群的基本特征
为获得Jax和Tac小鼠同笼前粪便菌群的组成情况,首先评估了3周龄小鼠(来自4个不同的Jax和Tac亲鼠)的粪便菌群。Jax和Tac小鼠粪便均含紫单胞菌科(Porphyromonadaceae),普雷沃氏菌科(Prevotellaceae),理研菌科(Rikenellaceae)和拟杆菌科(Bacteroidaceae)以及厚壁菌门的瘤胃菌科(Ruminococcaceae)和乳酸菌科(Lactobacillaceae)(图1A)。Jax 和Tac小鼠粪便菌群中,α多样性,包括香农多样性和均匀度指数以及OTU丰度没有显著性差异,而系统发育多样性(一种生物多样性指数,用于描述生态群落结构和多样性)有显著不同(p=0.0176)(图1b)。β多样性中两种小鼠BC指数(Bray-Curtis dissimilarity index)存在显著差异(图1C)。基于BC指数的NMDS图显示,Jax和Tac种群的粪便微生物有显著差异(图1C和图1D)。断奶时,不同性别小鼠的微生物组成无明显差异(图1D)。粪便微生物群中52个OTU的丰度在Jax和Tac小鼠之间显著不同(图1E),这反映了Jax和Tac小鼠之间菌群分类水平上的高度不同。
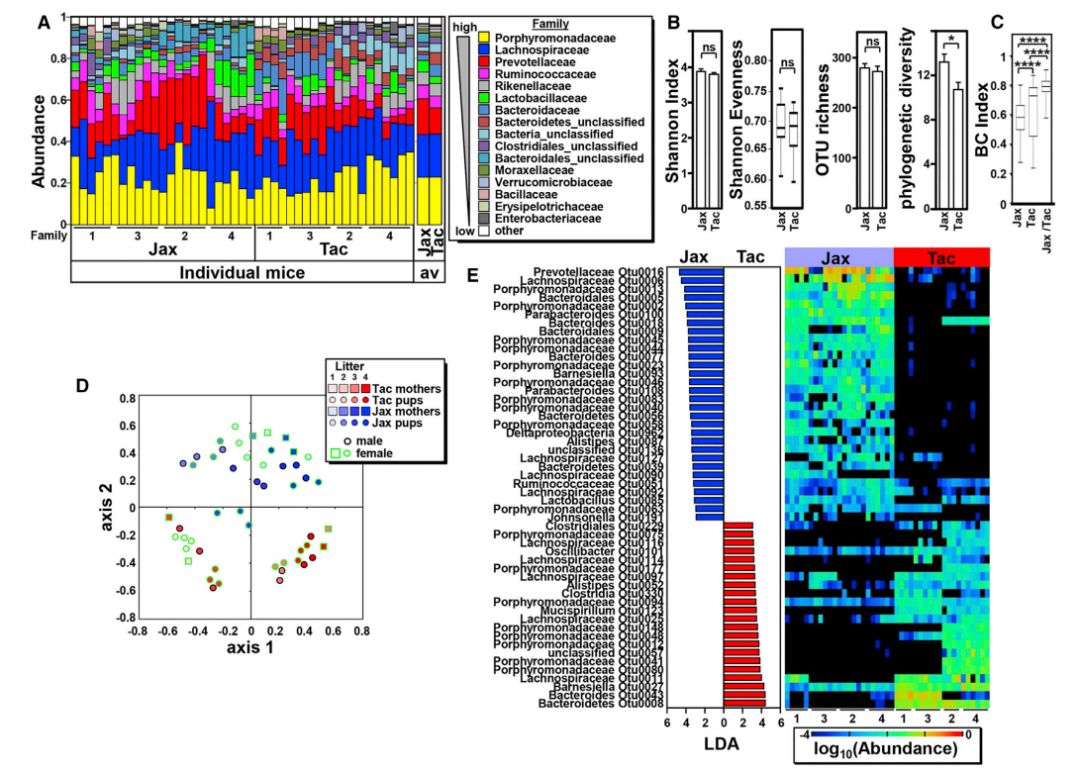
图1 Jax和Tac小鼠体内微生物群落结构的差异
2、断奶后Jax和Tac小鼠的菌群变化
基于BC指数的β多样性分析显示,断奶后第0、1、3、7、21和28天,Jax和Tac小鼠同笼组和sentinel对照组的微生物群落组成均随着时间的推移而变化,但Jax和Tac小鼠同笼组中变化更为显著(图2A)。为了测试同笼效应,本文比较了同笼和非同笼Jax小鼠种群的BC指数,结果表明,在同笼饲养的幼鼠中,β多样性有所减少。与此相反,在同笼和非同笼的Tac小鼠中都没有发现β多样性的减少(图2B)。这些结果表明,对β多样性的影响存在同笼依赖效应和非依赖效应。
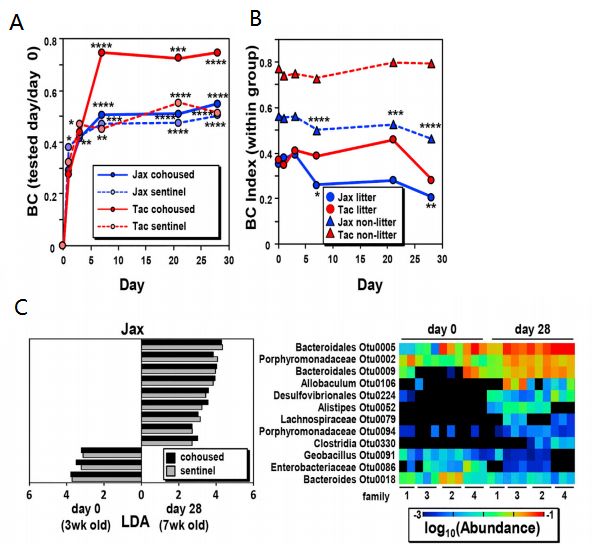
图2 Jax和Tax小鼠同笼期间微生物组成变化
为明确导致sentinel 组Jax小鼠笼依赖的微生物多样性减少的主要细菌,本文分析了第0天与第28天Jax同笼和sentinel小鼠显著不同的OTU。两组中第0天和第28天有12个OTUs的丰度显著不同(图2C)。这些OTUs包括6个拟杆菌门(Bacteroidetes)、2个变形杆菌门(Proteobacteria)和4个厚壁菌门(Firmicutes)(图2C)。
3、Jax和Tac小鼠同笼后使微生物群落均一化
与预期一样,同笼后Jax和Tac小鼠粪便菌群的β多样性降低(图3A)。同笼第3天,Jax和Tac小鼠粪便微生物的BC指数就出现了差异,在同笼7天内,Jax和Tac小鼠粪便微生物的BC指数几乎达到了平稳状态(图3A)。在第28天,同笼和sentinel对照组小鼠的BC指数均出现下降,这可以用断奶后年龄和笼龄依赖的菌群变化来解释(图2)。相反,除了在sentinel组Jax小鼠中第0天和第21天、第28天之间α多样性有轻微差异外,同笼和sentinel组Jax或Tac小鼠中没有观察到粪便菌群香农指数和系统发育指数的差异(图3B)。除Lachnospiraceae OTU0114外,Jax和Tac小鼠第0天粪便菌群中不同丰度的细菌OTUs在21天内均达到了相似的丰度水平(图3C)。单个小鼠BC指数的NMDS图也显示,延长同笼时间(达28天)使Jax和Tac小鼠的微生物群组成均一化(图3D)。进一步的分析表明,同笼Tac小鼠和sentinel Tac小鼠之间β多样性差异比同笼Tac小鼠和sentinel Tac小鼠之间的β多样性差异有所减小(图3E)。这些结果表明,同笼小鼠的菌群与Jax小鼠更接近。
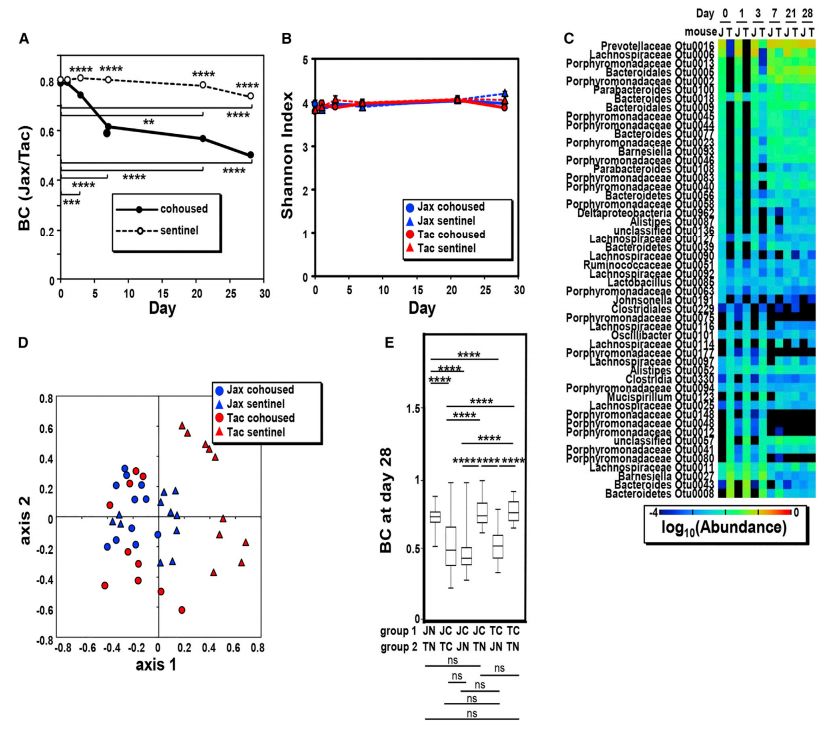
图3 同笼期间微生物群落均一化
4、同笼后的不同动力学和不对称菌群传播
LEfSe分析显示,与sentinel组小鼠相比,28天后同笼组多个OTU增加或减少(Jax见图4A, Tac见图4B)。通过对不同时间点的同笼组小鼠和sentinel组小鼠进行类似的比较发现,Tac小鼠中多数细菌在7天内丰度有所改变,而在Jax小鼠中,只有4个OTUs的丰度在同笼后第7天增加 (图4A和4B)。而在Jax小鼠中,大多数OTUs的丰度随延迟动力学而增加(到第28天)(图4A和图4B)。这些结果表明,细菌OTU在同笼小鼠体内的微生物群水平传播过程中,随着动力学的不同而改变其丰度。
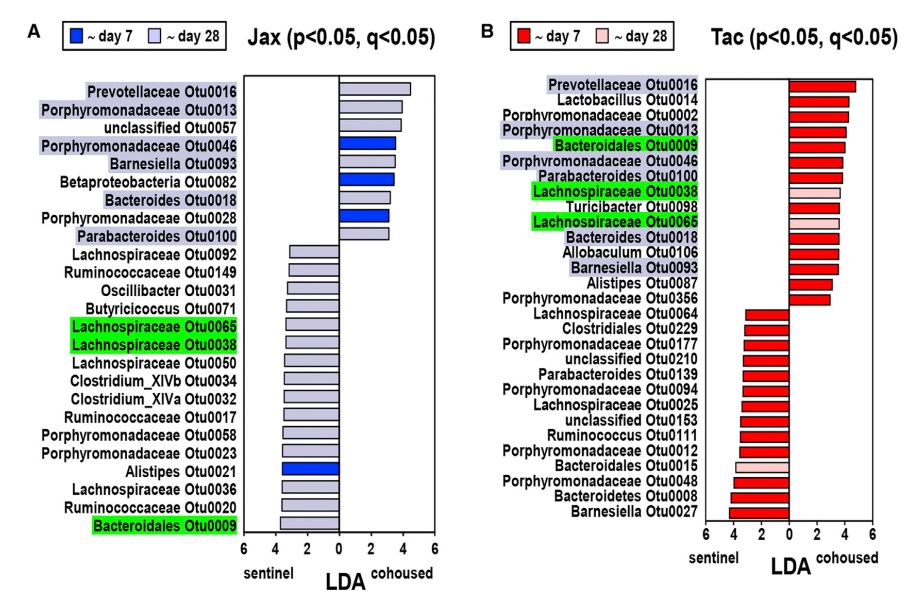
图4 Jax和Tac小鼠同笼后OTU的不对称动力学变化
本研究进一步描述了同笼期间Jax和Tac小鼠共有(共同的核心菌群)或独有的细菌种群的变化。同笼组和sentinel组Jax 、Tac小鼠的11个OTU (共同核心菌群)在所有时间点都有检测到,总丰度为8.2% ±3.7%,而34个OTU和13个OTU分别只在sentinel Jax和Tac小鼠中检测到,总丰度分别为在41%±14%和10.6%±5.1% (图5A)。Jax和Tac小鼠共有的优势OTUs主要属于紫单胞菌科(Porphyromonadaceae)和毛螺菌科(Lachnospiraceae)。在Jax小鼠核心菌群中只检测到几个科的细菌,只包含单个OTU Mucispirillum的脱铁杆菌科( Deferribacteraceae)则只在Tac小鼠核心菌群中发现(图5B)。研究发现,Jax和tac小鼠特有的核心OTUs分别约占总菌群的41%和11%(图5C),而Jax和Tac小鼠特有OTUs的组合丰度小于总菌群的2.2%(图5D)。同笼7天后,Jax小鼠的核心OTUs丰度在Tac小鼠中显著增加,而Jax小鼠中,Tac核心OTU丰度没有明显增加(图5C)。Jax和Tac小鼠特有的OTU在同笼后21天均有所增加(图5D)。Jax特有的OTUs丰度在同笼Tac小鼠中达到了sentinel 组Jax小鼠中的数量(图5D)。相比之下,sentinel组Tac小鼠特有OTUs对Jax小鼠的传播水平较低(图5D)。这些结果表明,在Jax和Tac小鼠同笼后,其核心菌群和特有菌群存在差异动力学和不对称的传播。
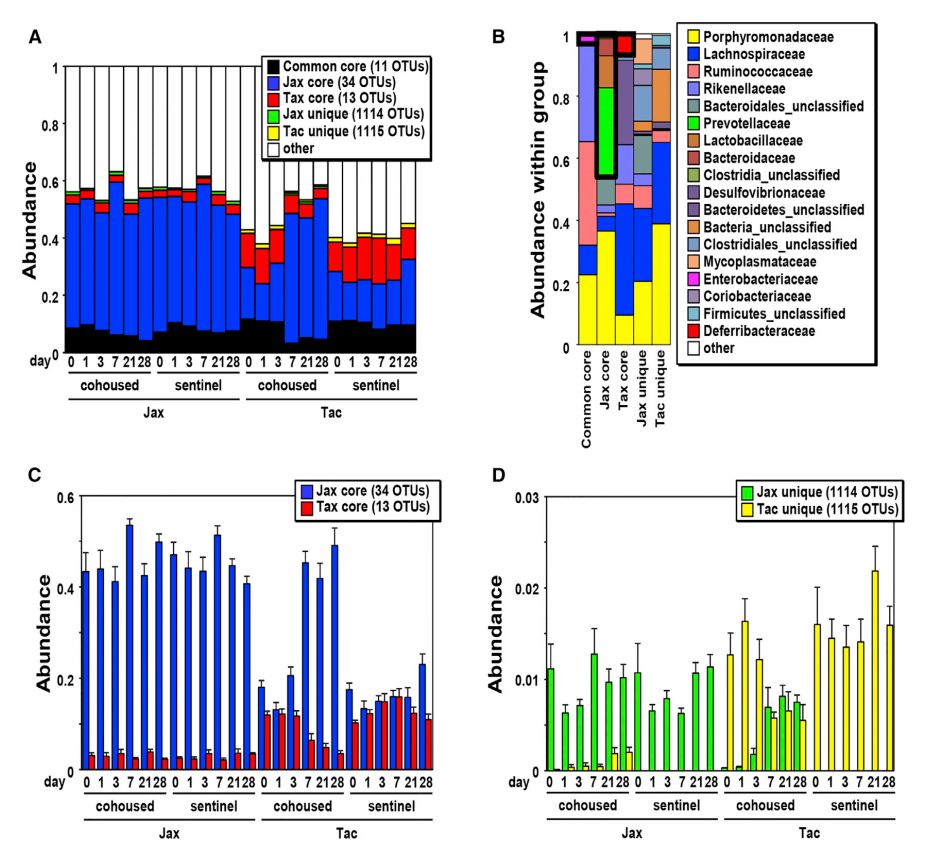
图5 核心及特异性微生物种群在同笼过程中的动力学
5、聚类分析揭示菌群之间潜在的积极和消极的交互作用
本研究使用所有小鼠之间的SparCC相关系数进行了综合聚类分析,以揭示微生物群落中潜在的正或负相互作用。研究确定了四个高度相关的共丰度组(CAGs),|SparCC| > 0.62 (相关性前1%),且所有CAGs包含负相关的OUT对,SparCC < -0.62(图6A)。最大的聚类包含27个OUT,并且占同笼小鼠中总丰度的26.9% ± 0.8%(图6A中group1)。值得注意的是,27个OUT中有12个是在同笼期间发生变化的细菌种群(图4、图6A和图6B)。其余三个聚类共含有24个OTU,占细菌总数的13.7% - 5.3%(图6A)。这些聚类,特别是第4组,与第1组的不同之处在于,它们几乎是相互排斥的分布;一个特定OTU的存在与另一个OTU的缺失或接近缺失相关(图6A和6B)。值得注意的是,所有的聚类都包含属于同一科的OTUs,这表明核心菌群中分类上相似的细菌之间存在负相互作用(图6A)。
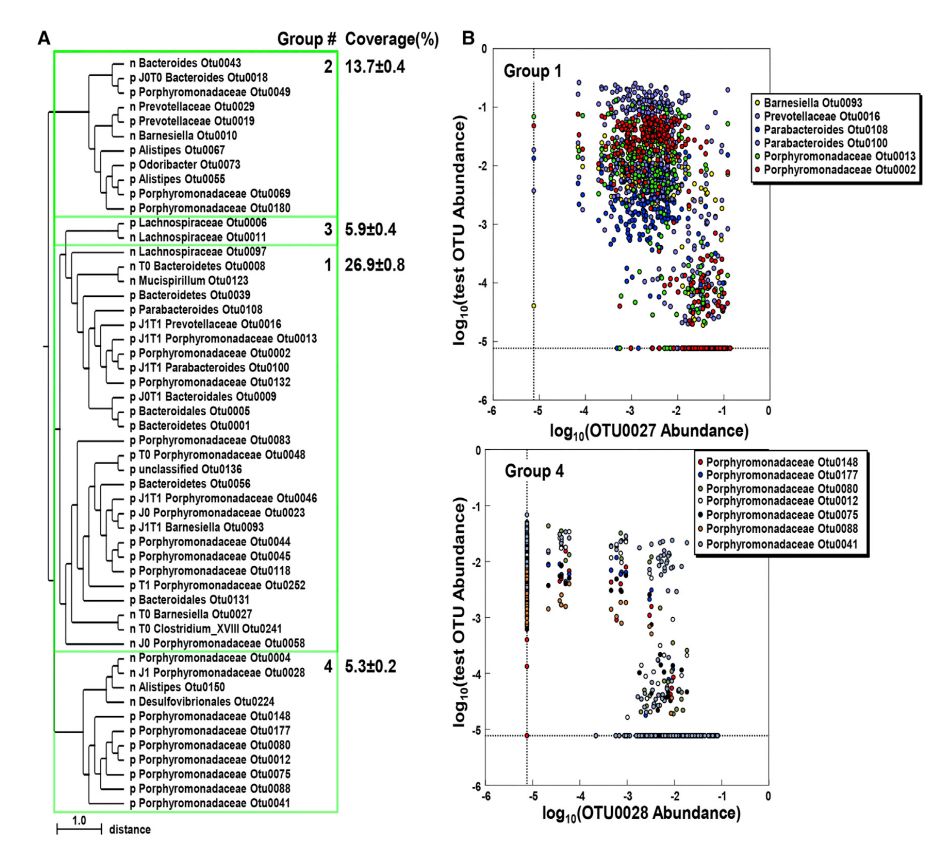
图6 Jax和Tac小鼠OTU丰度的负相关关系
研究结论
1. 同笼使得小鼠粪便微生物群在28天内几乎完全均一化,其中大多数细菌OTUs在水平传播7天后就达到均一化。
2. 同笼饲养和sentinel对照组的 Jax、Tac小鼠的微生物群落α多样性随时间变化不明显;而β多样性的变化中存在笼依赖和非依赖性影响。
3. OTUs的动力学和聚类分析表明,共生细菌的差异和复杂的相互作用在调节它们在肠道中的数量方面发挥了作用。
亮点
通过研究Jac和Tac C57BL/6小鼠同笼后微生物群落变化的时间动态和不同寄主群体间微生物群落均一化水平,以及小鼠断奶后,微生物群均一化所需的时间,为小鼠模型中微生物群的标准化、较少实验混杂因素提供了参考依据。
供稿:刘钰珠






