据世卫组织国际癌症研究机构最新发布的数据显示,乳腺癌现已成为全球第一大癌症。来自《中国乳腺疾病调查报告》的数据也表明,2003-09 年间,我国城市中乳腺癌的死亡率增长了 38.1%,其对于人类健康和生命安全产生了巨大威胁。
多年以来,科学家针对该疾病开展了深入研究,并且在 1998 年推出了首个 HER2 靶向药物赫赛汀(也称曲妥珠单抗,Trastuzumab)。尽管该药物为众多 HER2 阳性乳腺癌患者带来了生的希望,然而其疗效也具有明显的局限性,包括缺乏对肿瘤细胞足够的杀伤力,以及大量患者面临的耐药性问题。对此,相关研究人员试图通过开发 ADC 药物、免疫治疗等多种策略,以进一步提升这类肿瘤的治疗效果。
其中,来自宾夕法尼亚大学的张洪涛教授与 HER2 靶向治疗奠基人 Mark Greene 教授联合创立的杭州赛得康生物科技有限公司(CytoCan Corp.,以下简称“赛得康”)以差异化的治疗机制和新一代平台技术,直指HER2阳性癌症的突破性治疗,获得令人瞩目的初期进展。
该公司专注于多特异性融合蛋白药物研究,依托于自主研发的 AbZed 蛋白模块技术平台,针对癌症靶点设计并精确递送多特异性融合蛋白药物,从而精准增强对癌细胞的免疫攻击,获得活性更高、能抗耐药性的靶向大分子药物。
2 月 7 日,赛得康宣布超额完成数千万元的种子轮融资。本轮融资由 Forcefield Venture 领投,晶泰科技和 Bopu Capital 跟投,所得资金将用于进一步发展和优化 AbZed 平台技术,同时加速推动产品管线走向临床阶段。截至目前,赛得康已开发多个管线项目,其中与晶泰科技合作的 HER2 抗癌药物管线已进入临床前候选化合物(PCC)阶段。

▲图丨赛得康创始人、CEO 张洪涛博士(来源:受访者提供)
张洪涛于 1998 年在美国宾夕法尼亚大学取得药理学博士学位,后于该校病理及实验医学系完成博士后研究。自 2007 年起,其在宾夕法尼亚大学医学院病理及实验医药系任助理教授,后受聘为河北医科大学第四医院客座教授。他的主要研究方向为靶向药物在癌症及免疫疾病中的治疗、重组蛋白药物对癌症的靶向免疫治疗、以及巨噬细胞在免疫和肿瘤中的功能等,迄今已在国际权威科学杂志上发表论文 90 余篇。
使用模块化设计,像组装乐高一样“搭建”蛋白药物
早在上世纪 80 年代,当时尚在哈佛大学的 Mark Greene 教授便开展了靶向癌基因蛋白的单克隆抗体研究,其早期发现奠定了 HER2 靶向疗法。最终在1998 年,靶向 HER2 的药物曲妥珠单克隆抗体(Trastuzumab)被批准用于治疗 HER2 受体阳性的乳腺癌患者。在此之后,该药物还被批准用于联合治疗局部晚期或转移性 HER2 阳性胃癌等适应症。
早期研究证实,基于曲妥珠单抗的联合治疗方案能够有效改善相关患者的总生存期和无进展生存期,其对于 HER2 阳性乳腺癌等疾病的治疗产生了重大影响。然而,该药物对癌细胞的杀伤力不足,并且其存在于部分患者群体中的耐药性也不容忽视,这些问题为相关治疗带来了巨大挑战。
自 1994 年加入 Mark Greene 实验室后,张洪涛在针对于 ErbB 及相关受体(EGFR、HER2)的靶向治疗、工程化抗体等研究方向开展了深入探索。“在赫赛汀获批之后,众多研究人员长期致力于解决该类药物的固有问题,以便打造出效果更佳的‘二代赫赛汀’。”然而,一方面针对于抗体药物的增效研究道阻且长;另一方面,如何快速、有效地完成抗体药物的改造工作也是另一个绕不过去的难题。
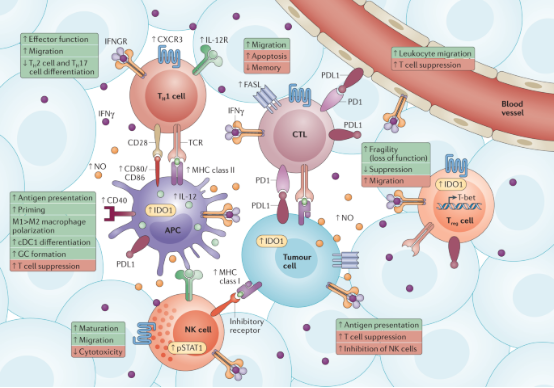
▲图丨IFN-γ 对于肿瘤微环境的影响(来源:Nature Reviews Immunology)
近年以来,免疫治疗成为继放化疗、靶向治疗之后的又一热门的肿瘤治疗方式。但是,对于乳腺癌来说,尤其是 HER2 阳性的乳腺癌,免疫治疗的效果并不显著,原因是免疫细胞不太容易突破癌细胞形成的“抵抗屏障”。如何在实现肿瘤靶向治疗的同时调节肿瘤微环境(TME),以提升免疫治疗效果,成为了张洪涛思考的方向之一。
在研究过程中,张洪涛团队证实 IFN-γ 细胞因子等能够有效增强针对于 HER2 的靶向抗体治疗,阻止肿瘤生长。基于肿瘤靶向与免疫治疗的双重进展,张洪涛开发了名为 AbZed 的模块化融合蛋白平台,以构建具有多特异性功能的癌细胞靶向蛋白药物。
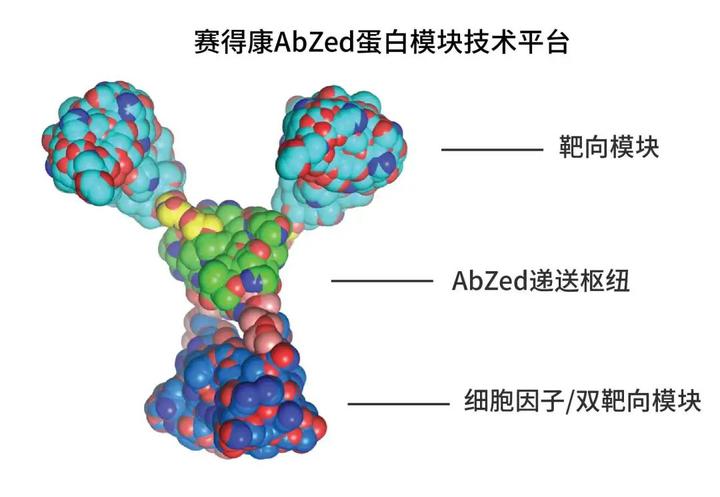
▲图丨AbZed 融合蛋白基础结构(来源:赛得康)
AbZed 融合蛋白由三类基础模块构成:即靶向模块、递送枢纽以及细胞因子模块。其中递送枢纽使用经过工程化改造的人源结构,不但可以结合免疫球蛋白,也能作为连接其它功能模块的“桥梁”,是目前仅有的可以搭载抗体分子的多特异性蛋白平台。围绕这一专有技术,赛得康已经取得多项专利成果。
“多特异性融合蛋白的核心在于模块化的蛋白结构,”张洪涛对此介绍道,“当‘导弹’主体的搭载能力通过了验证,后续的研发就像组装乐高一样,通过变换其中的模块,我们能够快速制造出很多种蛋白,每个蛋白都有多种不同功能,包括精确靶向癌细胞靶点、激发免疫调节等,全方位增强肿瘤治疗效果。”
利用 AI 技术解决蛋白质设计难题,快速推动首发管线进入 IND
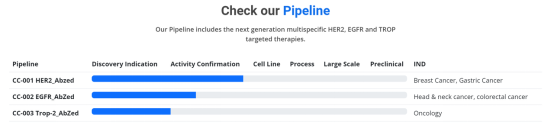
基于 AbZed 平台化的技术模式,赛得康的研究管线得以迅速扩展。目前,该公司已经建立起多项药物研发管线。其中,针对于 HER2、EGFR 和 TROP 等靶点的多特异性靶向疗法已相继进入前期验证阶段。
“目前动物体内实验数据已经证明,相较于单独使用 HER2 抗体或是 IFN-γ 与单抗的联合疗法而言,使用 AbZed 融合蛋白的疗法效果更佳、更简便,且该类融合蛋白在已经具有赫赛汀抗药性的肿瘤治疗中仍表现出优异活性。同时,针对肿瘤浸润巨噬细胞和淋巴细胞的检查也表明,AbZed 融合蛋白能够诱导肿瘤微环境产生变化,激发更多的免疫细胞侵入肿瘤组织。”据张洪涛透露,该公司的首发管线 HER2_AbZed 将在今年内进入 IND 申报阶段。