提供一些资料,希望可以帮助到大家
高中化学:氮族方面试题的解题方法与技巧
注意:
(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
收集装置:向下排空气法。
验满方法:用湿润的红色石蕊试纸置于试管口,试纸变蓝色;将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。
尾气处理:收集时,一般在管口塞一团用水或稀硫酸浸湿的棉花球,可减少氨气与空气的对流速度,收集到纯净的空气。也可以直接用浓硫酸吸收多余的氨气,但需要用倒置的漏斗,以及防止倒吸(如下图所示)
2、铵盐及NH4+的检验
(1)铵盐的物理性质:铵盐都是白色固体,均易溶于水。
(2)铵盐的化学性质:
①不稳定性:铵盐受热易分解,NH4Cl
NH3↑+HCl↑、NH4HCO3
NH3↑+H2O↑+CO2↑。
②与碱溶液反应:
在稀溶液中不加热:NH4++OH-=NH3·H2O。
加热或浓溶液:NH4++OH-
H2O+NH3↑。
③铵盐固体与强碱反应:2NH4+Ca(OH)2
CaCl2+2H2O+2NH3↑。
(3)NH4+的检验:未知液
呈碱性
湿润的红色石蕊试纸变蓝色,则证明含NH4(+)。
方法技巧:
1、喷泉实验的形成原理:
(1)形成喷泉的原理:形成喷泉最根本的原因是瓶内外存在压强差。当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。
(2)常见喷泉的形成主要有以下两类:
①极易溶于水的气体(NH3、HCl、SO2等)与水可形成喷泉;
②酸性气体(HCl、SO2、NO2、CO2、H2S等)与NaOH(aq)也能形成喷泉。
(3)喷泉实验成功的关键:
①盛气体的烧瓶必须干燥;
②气体要充满烧瓶;
③烧瓶不能漏气(实验前应先检查装置的气密性);
④所用气体能大量溶于所用液体或气体与液体快速反应。
(4)常见的喷泉实验装置:喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来使喷泉产生。
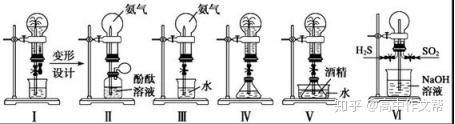
装置I:打开止水夹,即可使少量的溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。
装置Ⅱ:挤压气球,即可使少量的溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。
装置Ⅲ:去掉了胶头滴管。打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉。(开放性问题,或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)。
装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液喷到烧瓶内。
2、实验室制取氨气的其他方法:

3、防倒吸装置:
易溶于水的气体(HCl、HBr、NH3)进行尾气吸收时均需要使用防倒吸装置:

三、硝酸
1、物理性质:硝酸是无色易挥发的液体,有刺激性气味,与水互溶。
2、化学性质:
(1)具有酸的通性:稀硝酸能使紫色石蕊试液变红色,浓硝酸能使石蕊试液先变红色色,微热后褪色。
(2)不稳定性:硝酸见光易分解,硝酸浓度越高越易分解:
注意:
硝酸显黄色是由于硝酸见光或受热发生分解,生成的NO2溶于浓硝酸所致,所以消除的方法是通入O2(或空气),使其发生反应4NO2+O2+2H2O= 4HNO3。保存时应保存在棕色试剂瓶中,并置于阴凉处。
(3)强氧化性:硝酸无论浓、稀都有强氧化性,而且浓度越大氧化性越强。
①与金属反应:稀硝酸与铜反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
浓硝酸与铜反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
②与非金属反应:如浓硝酸与C的反应为 C+4HNO3(浓)
CO2↑+4NO2↑+2H2O。
③与还原性化合物反应:硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。如稀硝酸与FeSO4溶液反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
④王水:由浓硝酸与浓盐酸按体积比1∶3混合所得,具有更强的氧化性,能使Au、Pt溶解。
方法技巧:
1、涉及HNO3的离子反应常见的易错问题:
(1)忽视NO3-在酸性条件下的强氧化性。在酸性条件下NO3-不能与Fe2+、I-、SO32-、S2-、Br-等还原性较强的离子大量共存。
(2)在书写离子方程式时,忽视HNO3的强氧化性,将氧化还原反应简单的写成复分解反应。
2、金属与硝酸反应计算题:
(1)思维模型:

(2)计算中的守恒思想的应用:
①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO3-的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
