好几个答主都已经给出了反例,食用昆虫的情况多了去了。无论是炸串(蚂蚱)还是烤了吃(蚕蛹),磨成粉(蚂蚁)还是中药制剂(蝉衣,或者,呃呃,甚至著名的康复新液-美洲大蠊),昆虫入口的例子数不胜数。小时候国庆节广场上摆摊卖炸昆虫的可多了)
2. 人和昆虫格格不入,那必然
“人”家是具几丁质外骨骼的节肢动物,当然怎么看都和你差别巨大了.gif
不过心理作用也是可以被克服的。例如,隔壁软甲亚纲可是出了“第一只被人吃的螃蟹”(一时间竟说不出是谁该有心理作用(雾))
3. 推广有风险
还有很重要的一点,似乎没有答案提到,那就是食用昆虫之后,部分人可能产生异体蛋白反应,进而导致过敏性休克,严重的可致死。说白了也就是对昆虫蛋白过敏了,这样的新闻/病例并不少见。事实上只要放眼到整个节肢动物门,就很好理解了,毕竟对于甲壳类过敏的朋友应该也不少。海产品有很多好处,也并非适合所有人不是)
你我不过敏不代表其他人也不过敏,一旦推广了基数上来了,出现问题的概率也就大了。
我没有查到专门的统计学研究,去分析食用昆虫导致过敏的概率是多少,至少现在肯定没有花生酱导致过敏的概率高,毕竟后者全球范围内食用,而前者在某些地区或特定人群中的发生率可能相对较高,毕竟还没推广开来。不过有检测机构发布的一份过敏患者检测样本统计数据显示,对于蟑螂的阳性率可以达到5%。
(以后,食品包装袋上的“此生产线也加工含有甲壳纲类动物制品”该改成“此生产线也加工含有甲壳纲、昆虫纲类动物制品”咯!)
4. 有风险该如何推广?烹!
虽然雀食存在过敏的挑战,但是人类也确实瞥见了如同问题描述信息中所述的昆虫类食物带来的优势,为此也采取了许多办法来降低过敏发生的概率。
既然罪魁祸首是蛋白质,那么就让它变性,结构发生改变好了!
美味且富含蛋白的蚕蛹可谓是首当其冲——成为被我们的广东朋友开涮的对象。深圳大学医学部的一篇名为“Effect of heat, enzymatic hydrolysis and acid-alkali treatment on the allergenicity of silkworm pupa protein extract(加热、酶解和酸碱处理对家蚕蛹蛋白提取物致敏性的影响)”详细介绍了这一切:
蚕蛹:得了得了,我全招了!这波是狡蚕死,我蛹被烹得妥妥的啊
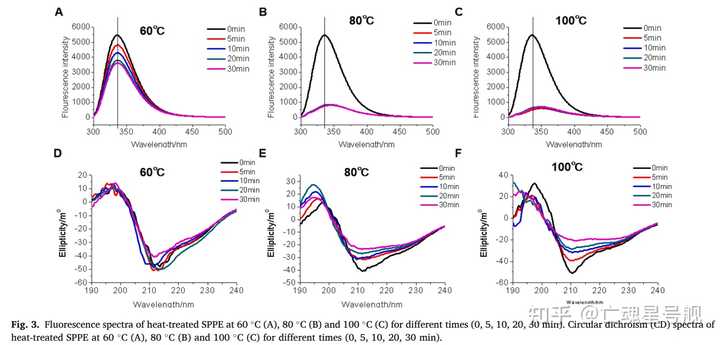
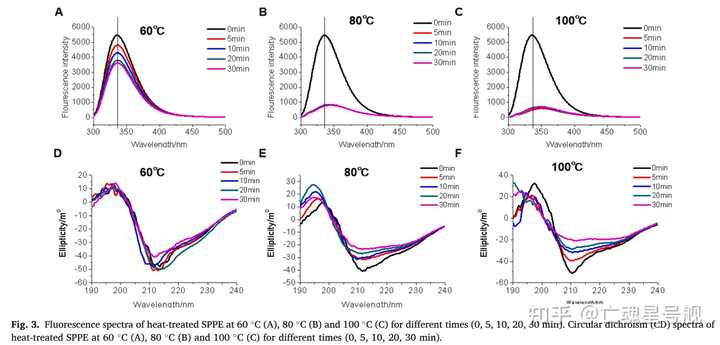
在许多亚洲国家,蚕蛹是营养优质的食用昆虫,但食用蚕蛹会导致严重的IgE介导的过敏性疾病。本研究旨在探讨加热、酶解和酸碱处理对家蚕蛹蛋白提取物(SPPE)致敏性的影响。当温度高于60 °C时,加热降低了SPPE的致敏性。光谱学研究表明,SPPE在加热时会展开构象,这取决于温度和时间。酶水解表明,25-33 kDa的SPPE含有胃蛋白酶和胰蛋白酶抗性过敏原。酸碱处理结果表明,低pH值可促进SPPE水解,降低其致敏性。因此,加热、酶解和酸碱处理可以显著降低SPPE的致敏性,耐热、耐酶和耐酸碱的过敏原为25至33 kDa SPPE。本研究有助于开发蚕蛹蛋白的制备方法。怪了,那为什么我吃烧熟的海鲜也会过敏?
甚至有例子发现某些海鲜生吃并没有发生过敏现象,反而是烧熟了吃过敏了???难道我高中生物学的是错的嘛。
仔细一想,变性没错,结构改变也没错,但是物质不会凭空消失,难不成是歪打正着生成了新的可被识别的致敏结构?或者说极少数结构降温了又恢复了?
猜对了。尽管与反应性相关的表位通过高温、pH的变化或者酶的加工而改变,因此与致敏性的降低有关,但值得注意的是,这些过程也可以产生新的结合位点,然后诱导潜在的致敏和过敏反应。
另外,昆虫原肌球蛋白的二级结构在加热到80°C以上时会塌陷,但冷却后可能会重新形成。(不是,你怎么也学PCR里的DNA,给我变性了又(退火)复性啊(恼)你要延伸嘛.jpg)
The side effects of these allergenic reactions can be decreased through enzymatic hydrolysis, and the use of other technologies such as ultrasound and microwave, which have the capacity to disrupt the secondary structure of certain allergens and as a result decrease their recognition by IgE, but it is important to note that new active sites can be generated during processing.
Although the tropomyosin helical secondary structure collapses when heated above 80 °C, it may reform upon cooling.
如果你想详细了解昆虫蛋白的现状,除了看TED讲座,我以为下面的这篇文章值得仔细研读:
本综述旨在提供食用昆虫蛋白和昆虫衍生肽生物活性的最新概述。将食用昆虫的必需氨基酸含量与众所周知的蛋白质来源进行比较,以证明食用昆虫具有满足不同人群蛋白质质量要求的潜力。然后总结了目前昆虫蛋白提取的方法,包括每种方法的蛋白质提取率和最终蛋白质含量的比较。此外,为了提高我们对昆虫蛋白的理解,讨论了昆虫蛋白的功能特性。生物活性肽可以根据各种酶水解方案释放。在这种情况下,已经讨论了昆虫肽的生物活性特性(抗高血压、抗糖尿病、抗氧化和抗炎特性)。然而,昆虫蛋白中存在的过敏原仍然是昆虫产品消费的主要问题和未解决的问题。因此,提出了交叉反应的分析以及可用于降低致敏性的不同方法。昆虫蛋白水解物/肽的多样化研究最终促进了昆虫蛋白的利用,新兴的加工技术也促进了昆虫蛋白在不同用途的广泛利用。
在文章当中实验人员模拟了人体真实的消化环境,包括胃当中中的酸性和肠道的弱碱性,并且配上体温,昆虫蛋白的水解程度从3~100%不等。并且还揭示了TM和AK这两种导致过敏的蛋白。
I. 泛过敏|原肌球蛋白(TM)
罪魁祸首之一是泛过敏|原肌球蛋白(TM),科学家通过“自下而上”的方法(从氨基酸序列、理化性质分析→蛋白质结构、抗原表位、过敏肽本身分析),揭示了昆虫中原肌球蛋白的潜在致敏性和作用机制。
脊椎动物的TM和无脊椎动物的TM在氨基酸组成方面有55%的同源性,而甲壳类动物和软体动物之间的同源性是65%,那么昆虫呢?
昆虫的TM与甲壳类动物和软体动物在氨基酸序列方面当然也具有同源性。研究已经证明,蟋蟀的TM与已知的贝类TM具有超过60%的同源性。所以对于贝类过敏的朋友很可能也对蟋蟀过敏
(蟋蟀:蛤?)
文章也指出了昆虫和无脊椎动物的TM都具有耐热性和抗蛋白水解性。虽然原肌球蛋白的二级结构在加热到80°C以上时会塌陷,但冷却后可能会重新形成。
II. 精氨酸激酶(AK)
在无脊椎动物中报告的另一种过敏原是精氨酸激酶(AK),这是一种参与能量代谢和肌肉动员的酶。AK具有耐热性和抗消化性。最近的一项研究表明,对于蟋蟀和黄粉虫过敏的受试者存在有限的 AK交叉反应(Cross-Reactivity)特性。AK的氨基酸序列在不同昆虫物种之间仍然表现出高度的同源性,凸显了进一步研究AK交叉反应的重要性。
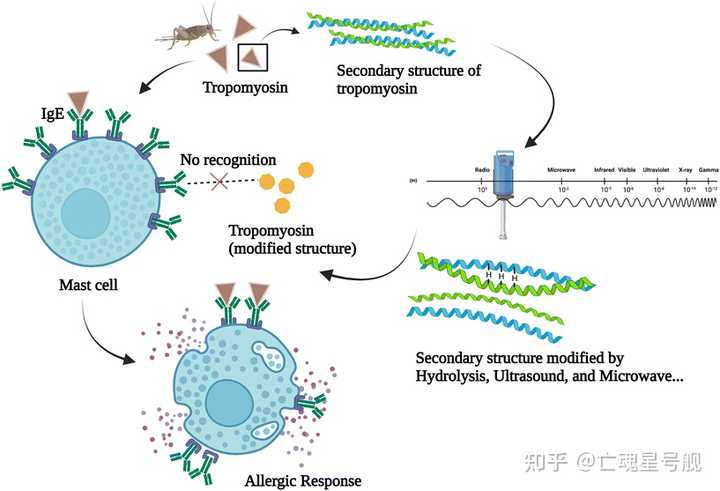
除了通过水解,微波和超声波处理也能够降低昆虫原肌球蛋白的致敏性
这一次,科学家采用微波辅助水解:
例如,为了降低原肌球蛋白的过敏性,在125°C下进行15分钟微波处理(1000W,2.45GHz)可降低75%的过敏性,这种减少与二级结构修饰有关。
The decrease in allergenicity can be explained by the changes in the protein secondary structure; α-helices and β-sheets are stable structures and are hard to modify, and therefore, it makes it difficult for antibodies to combine.
α-螺旋和β-(折叠)片层的增加了,导致致敏受试者的 IgE 识别机会减少。
尽管理化性质上α-螺旋比β-折叠更加稳定,但是在免疫学上,两者都因为结构规则、不易变形,较难结合抗体,一般不作为抗原表位。
Hall等人(2020)还报道了传统酶水解和微波辅助水解之间原肌球蛋白-IgG结合能力的差异。他们发现,微波水解的 G. sigillatus (灶马蟋)蛋白获得了最低的原肌球蛋白-IgG 结合。
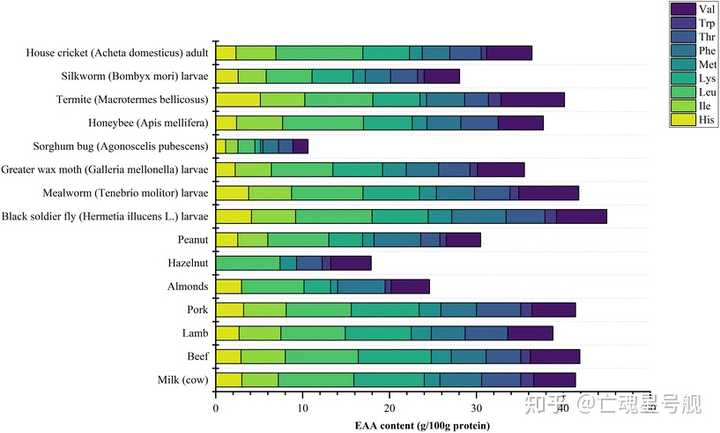
昆虫来源和常见食物来源必需氨基酸含量的比较,从上往下:家蟋蟀成虫、家蚕幼虫、白蚁、蜜蜂、食高粱的臭椿、大蜡蛾(蜡螟)幼虫、黄粉虫、黑水虻(黑兵蝇,专吃厨余垃圾)幼虫、花生、榛子、杏仁、猪肉、羊肉、牛肉和牛奶总结
我们为什么不食用昆虫?其中的很大的一个原因是过敏。
“汝之蜜糖,彼之砒霜”,昆虫蛋白的推广还需要采取更成熟的致敏原处理办法,不能着急!
说不定在不久的未来,Family Mart真的推出了一款低脂昆虫蛋白餐,只需要放入微波炉,按“7”,就可以等待 美 味 咯,不知道各位会愿意尝试吗)
参考DOI: 10.1016/j.foodchem.2020.128461DOI: 10.1111/1541-4337.12989类比煮虾得出的结论:DOI: 10.1039/d3fo02865hDOI: 10.2500/aap.2021.42.210057是指某个抗体针对一个特定抗原产生,但也能识别并与结构相似的其他抗原结合的现象。这篇文章收入数据库时的介绍里有一句:"...a decrease in α-helices and turns and an increase in β-sheets."不排除是打错的可能,因为与原文有些不符。与之相反,β转角为凸出结构,多出现在蛋白质抗原表面,有利于与抗体结合