在本文中,我主要想从以下几个方面来讨论现有的关于Carbon Dioxide(二氧化碳)”捕集“技术:
(当然,“捕集”是题主的说法,措辞上的东西我们不做深究)
【Carbon Dioxide排放的背景以及研究重要性】
我们先不讨论二氧化碳与温室效应之间可能的关系,仅仅从数据上来看,二氧化碳在空气中的含量近年来的确有很大的增加量,当然也有人说这是因为我们现在处于地球生态圈二氧化碳浓度自然起伏波动的上升期的原因,我们在这里也不排除这种说法,但还是按照大多数人的说法来讨论:
根据World Resources Institution的研究[1],二氧化碳从1960年至今在空气中的含量增长如下图所示:

上图中,横坐标是年份,纵坐标是二氧化碳在空气中的含量(标尺为百万分之一)
以及:
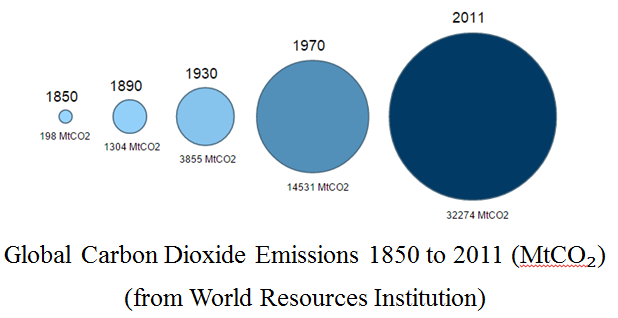
这张图表示的是从1850年起的二氧化碳排放量,2011年的二氧化碳排放量达到了1850年的150倍。这无疑是一个巨大的差距。究其原因,相信大家都心知肚明,19世纪中叶以来,飞速发展的工业技术的应用,急剧增加的人口数量与化石燃料的大量应用,都是导致二氧化碳排放量增加的重要原因。
而近些年来,关于温室效应的讨论也一直是处于风口浪尖,有支持的,也有说阴谋论的,这不是本文主要要讨论的内容,技术是独立于意识形态而存在的。
按照比较主流的说法,空气中过多的二氧化碳会对生态环境起到不好的作用,如何控制空气中的二氧化碳含量?无非是两个方面,一曰”治标“,一曰”治本“。”治本“,需要从源头上控制碳排放,开发清洁能源;”治本“,就是对空气中已有的过多的二氧化碳进行处理与再利用。显然,本文讨论的是”治标“的方面。问题的解决依赖于标本兼治,若欲此,非社会的各个领域协同合作不可。
【现有阶段关于二氧化碳的利用途径的构思与前沿性实践】
在2014年,George A. Olah(1994年诺贝尔化学奖得主)在CSR(Chemical Society Reviews)上作为通讯作者发表了题为Recycling of carbon dioxide to methanol and derived products–closing the loop(从二氧化碳到甲醇及其衍生产物的循环——闭合的环路)的文章[2]。在此文中,作者给出了一幅关于二氧化碳处理与再利用的构想图:
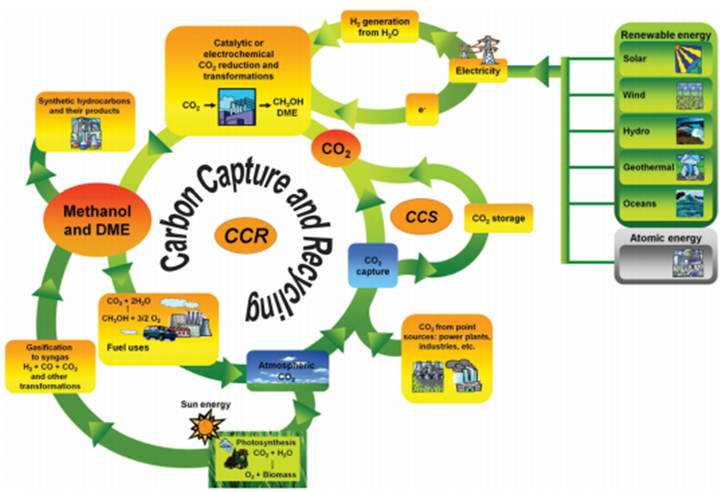
首先,文章提到了CCS(Carbon Capture and Sequestration),也就是二氧化碳的捕获与隔离存储,即通过现有手段收集空气中的二氧化碳,加压存储在地下。这实际上也算是无奈之举,就像现今通过掩埋处理核废料一般。终究不是长远之策,但毕竟可以起到一个storage(存储)的作用。
而更加有希望,而且更加明智的选择,应该是CCR(Carbon Capture and recycling)技术,收集空气中的二氧化碳,作为碳原料来进行化学上的合成,循环再利用。典型的产物有诸如甲醇极其衍生物,烷烃,一氧化碳等等,在某些精细化工合成中也有用武之地。
一个与之的类比就是Haber的拯救,或者是多养活了数十亿人的合成氨技术,由于找到了合适的催化剂(最早的铁基催化剂)实现了简单地将空气中的氮气直接与氢气合成转化为氨气的反应,这项技术给不同的人带来了不止一个的诺贝尔奖。而相对应二氧化碳固定的技术,我觉得至少也是诺贝尔奖级别的研究。
二氧化碳的固定想法虽好,实际实现起来却是困难重重,那在这里,我首先要科普一下CCR技术的难点在哪里:
首先我们知道,二氧化碳是生命体的代谢产物,也是含碳燃料或者有机物完全燃烧的产物,化合价为正四价,按照高中化学的说法就是形成了惰性的电子结构,化学性质非常稳定。而将其转化的过程肯定是一个需要外界提供各种形式能量的过程(热能,光能等等),倘若投入的能量不能明显少于产出的效益的话,现阶段是不可能有任何大规模的实际应用的。
自由能常常用来衡量一个反应自发发生与否:
△G=△E-T△S+P△V
我在这里就不具体讨论公式了,有兴趣的可以去查阅物理化学相关的内容。[3]总之二氧化碳的转化是一个从稳定物质到不稳定物质的过程,一个很困难的过程。
但是再困难的过程也有解决的办法,当年合成氨技术出现之前,也觉得直接将稳定地氮气变成氨气是近乎不可能的,然后,由于找到了合适的Catalyst(催化剂),使得这项技术逐渐趋近成熟,并且多养活了几十亿人(应该有吧)。类似的,寻找合适的催化剂也是一个比较常见思路。
而催化领域主要又分为均相催化(Homogeneous)和多相催化(Heterogeneous)两种。简而言之,均相催化就是催化剂与反应物产物什么的均匀地在分子层次上混合在一起反应,多相催化是催化剂和反应物产物在物理上接触,表界面上发生反应。前者接触充分,原理理解较清楚,后者易于分离处理,循环利用,各有优劣所在。
还是在George A. Olah的文章之中,他向我们介绍了二氧化碳的一些在实验室转化的实例考虑到这篇文章更多的科普作用,所以我们就不详细分别讨论均相和多相反应了。另外一些其他的相关文章中的例子也会放在之后的讨论之中。
1.甲醇以及其衍生物
Hydrogenation(加氢)反应实际上是最早研究的一系列反应之一,我们知道,常见的化石燃料多事由碳氢化合物构成,二氧化碳里面有碳元素,那么只要加上氢元素,是不是又能够成新的燃料了呢?最简单的含有一个碳的有机物,我们知道非甲烷(天然气)不可,那就是用二氧化碳和氢气直接合成甲烷,再加上副产物有水就行了?实际上二氧化碳中的氧原子可以不完全跑掉,比如说得到甲醇,而一个甲醇分子之中有一个碳原子,一个氧原子和三个氢原子。甲醇衍生物一般指甲醛,甲酸,甲酸甲酯这些东西。另外,我们一般把这些只有一个碳原子的有机物叫做One-Carbon Block,起到了一种搭建更复杂的有机物的”砖石“的作用。
例如,在金属铑的配合物或者一些其他贵金属比如说铱,钨甚至贱金属钼,铁,钴的羰基化合物的的催化下,经过一个瀑布型的连续催化反应,先得到甲酸,在进行酯化,最后加氢得到甲醇。
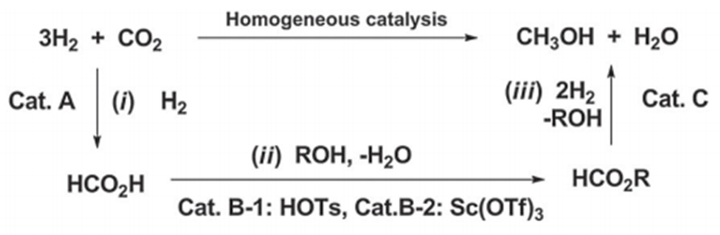
甲醇衍生物方面的报道还有很多,比如2011年Ekambaram Balaraman等人在Nature Chemistry发表的一篇文献中,也介绍了一些关于从二氧化碳一氧化碳得到甲醇的过程。[4]
更为有趣的是,2011年Robert D.Richrdon等人在Nature Chemistry上发表了名为A renewable amine for photochemical reduction of CO2(可更新的有机胺参与的二氧化碳光化学反应)的文章。
我们知道,植物光合作用可以表示成如下图所示:
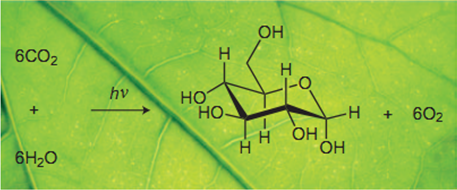
而这篇文章中,利用有机胺作为催化剂,在光的催化下多步反应,最后净反应居然是二氧化碳加上水得到了甲酸与氧气!
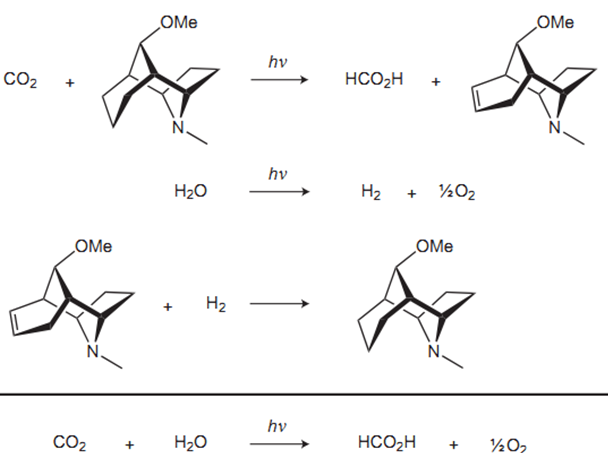
是不是与光合作用已经十分类似了?为此,Nature Chemistry杂志特别还刊登了Josef Michl教授(the Department of Chemistry and Biochemistry at the University of Colorado at Boulder)的一片针对此的题为Photochemical CO2 reduction: Towards an artificial leaf?(二氧化碳光化学还原:通向人造树叶的途径?)的评论。[6]然而这毕竟还只是实验室的新兴事物,没有经过大量时间的进一步研究与实践,是不可能真正大规模应用的,甚至连能不能利用都还不一定,但至少提供了这样的一个方向,引领者其他的科研工作者想着可能的方向努力。
这里我们得到的甲醇及其衍生物,作为工业上的重要原料可以进入我们日常生活中的方方面面。
2.向甲烷前进
直接利用二氧化碳合成甲烷也是被关注的课题,在2014年的Angwandte(德国应用化学杂志)上,Xianguang Meng等人(通讯作者为叶金花教授)发表了题为Photothermal Conversion of CO2 into CH4 with H2 over Group VIII Nanocatalysts: An Alternative Approach for Solar Fuel Production(以VIII族元素纳米催化剂实现的二氧化碳与氢气的光热转换合成甲烷:一种太阳能燃料的可选获得方式)的文章。[7]
在该篇文章中,研究人员通过研究负载在氧化铝上面的各种VIII族贵金属催化剂对于二氧化碳转换反应的效果,实现了二氧化碳加氢气得到甲烷的反应。其有一示意图如下:
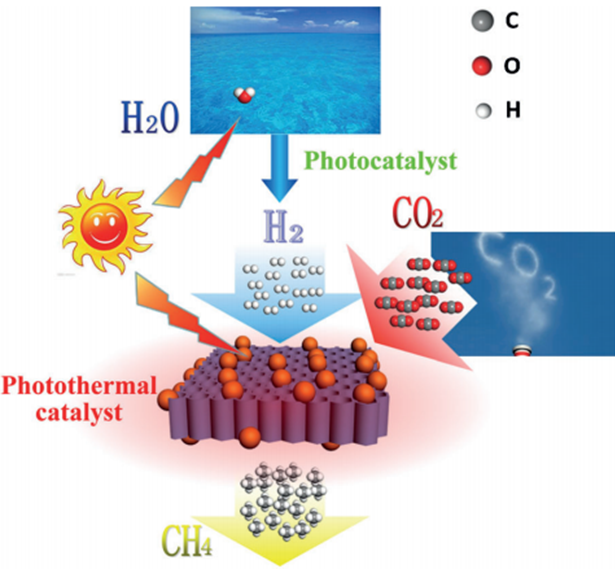
这也是属于类似的美好前景,然而依然有很长的路要走。
3.那就去掉一个氧原子吧
二氧化碳去掉一个氧原子自然也就变成了大家也是非常熟依的一种东西:一氧化碳,煤气。但是我们知道煤气并不是一个好燃料,但是!一氧化碳与氢气在一定的催化剂(主要是铁系)作用下,能够发生Fischer-Tropsch反应(费托反应),[8]合成碳链较长的碳氢化合物,这是十分有意义的!去年厦门大学王野教授到中国科大作讲座的时候特意谈到了选择性合成固定碳数目的碳氢化合物,因为不同长短的碳链往往决定了其不同的用途:是柴油还是汽油,是用于化工,或是用于航天,无限可能。
但二氧化碳能不能作Fischer-Tropsch呢?有人试过也取得了不错的结果,不过相当于是把二氧化碳向一氧化碳转化的步骤与Fischer-Tropsch简单地合起来了而已。
还是说到具体的例子上来,向Carbon Monoxide(一氧化碳)转化的,这样的文章也有很多,比如说有一种叫做DRM的反应(Dry Reforming of Methne)的方法就是专门讲甲烷与二氧化碳反应得到一氧化碳和氢气的。Devendra Pakhare和James Spivey在CSR(Chemical Society Reviews)上发表过一篇题为A review of dry (CO 2) reforming of methane over noble metal catalysts的综述,[9]具体的细节我这里就不给出来了。
另外一个可能更有趣的例子是,在2010年的Science上,William C. Chueh等人发表了题为High-flux solar-driven thermochemical dissociation of CO2 and H2O using nonstoichiometric ceria(通过非化学计量比的铈土实现的高通量太阳能驱动二氧化碳与水的光热解离)的文章,[10]器示意图如下图所示:
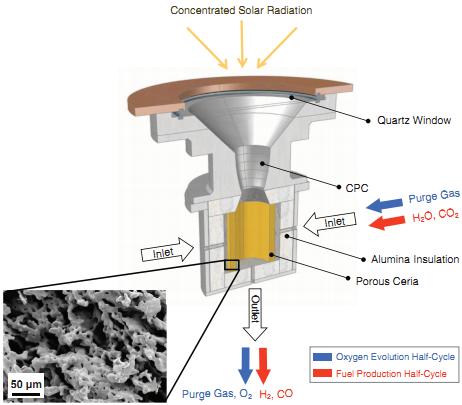
进来的是水和二氧化碳,出来的是氧气和氢气一氧化碳,是不是也是非常理想?或者我们认为里面包括了一步光解水的过程。无论如何,在实验室实现都不是问题,但是如何工业化,如何大量生产,才是问题的关键所在。
4.其他的一些奇奇怪怪的分子
在某些化学品的生产过程中,二氧化碳也能起到一些有趣的作用,比如合成丙醇,[11]二甲基甲酰胺,[12]某些羧酸,[13]草酸,[14]羰基插入反应,[15]甲基化[16]等等领域皆是如此,不过即便真真工业上技术完全成熟的话,实际意义肯定没有之前提过的那些基本的合成过程大。我相信这些精细化工方面的东西也不是题主提问的主要初衷吧,但至少还是提出一下,而且这方面的研究比如羰基插入反应,是要远早于上文提到各类二氧化碳收集反应的。
【与光合作用的比较讨论】
说实话本来不想有这一个小节的,但是看见题主问了与植物吸收二氧化碳相比如何,那我就说几句。现阶段的二氧化碳利用或者包括光解水,纳米技术这些东西,都是处于一个刚刚起步的阶段。二氧化碳的利用无论是从效率,条件的温和程度,与植物的光合作用相比,都还是远远不及的,人类至少把酶搞清楚了再说。
说实话,现阶段来说,人类玩的这些伎俩与自然界千万年来的精心雕琢相比,还是犹如婴儿一般。
庄子有言:
秋水时至,百川灌河;泾流之大,两涘渚崖之间,不辨牛马。于是焉河伯欣然自喜,以天下之美尽在己。顺流而东行,至于北海,东面而视,不见水端。于是焉河伯始旋其面目,望洋向若而叹曰:“野语有之曰:‘闻道百,以为莫己若’者,我之谓也。且夫我尝闻少仲尼之闻而轻伯夷之义者,始吾弗信;今我睹子之难穷也,我非至于子之门则殆矣,吾长见笑于大方之家。”
但是这并不能阻挡我们发展科学技术的步伐,不是么?我相信总有一天,人类的技术能够和自然形成的生命活动媲美,甚至有过之而无不及。
【二氧化碳利用的工业生产实例】
虽然二氧化碳利用的技术还处在理论探索的初级阶段,但是已经有某些地方开始尝试将其结合到工业生产之中,举两个典型的例子,其中比较有名的一个就是Carbon Recycling International在冰岛上建造的一个实验性的工厂,在这样的一个工厂中,有这样的几个主要反应:
a.用冰岛本身丰富的地热能发电
b.用电电解水得到氢气与其他副产物
c.用氢气与空气中收集的二氧化碳进行反应得到甲醇
这样的一个工厂,每天的产物量在十吨左右,虽然并不是很多,但这毕竟是一个带有实验性质的工程,已经算是一个非常成功的尝试了,这是在George A. Olah那篇综述里面有提到的。[2]其照片如下:

另外,就在今年九月十日的Science网站上,刊登了一篇Robert F. Service所写的题为Feature: There’s too much carbon dioxide in the air. Why not turn it back into fuel?的文章,[17]里面详细的介绍了另外一种利用太阳能与二氧化碳的方式,有兴趣的各位可以去看一看。
在日本,三井化学(Mitsui Chemicals)计划建造一个用二氧化碳与氢气每年生产100吨甲醇的工厂,其中氢气来源于用太阳能光解水,这两个技术联合起来,能有这个产量也已经是非常不错的了,要知道冰岛那个采用的还是传统的电解水技术呢。
【更为广阔的前景展望与可能引起的新问题】
二氧化碳转化,生物质利用,清洁能源等等其实都是属于绿色化学研究的领域。
你们往往只看见了氰化物,看见了污染,看见了非法添加剂。
君不见这些乱七八糟的东西基本上都是非化学行业的人因为追求利益,缺乏知识或者玩忽职守而造成的恶果,最后锅都给了化学家。
天津港爆炸,很大程度上不也是企业行政管理引起的么?如果他们按照化学行业制定的标准来正确存贮这些危险品,实现普及了相关知识,做到了防范于未然,问题又怎么会这么严重?
当然化学家里面也有黑心者,但那毕竟是少数。
现如今化学家尽心尽力来收拾这些本不是他们砸的烂摊子,当然我们不否认这对科学技术的进步也有促进作用。若无各种各样的问题,也许就会缺乏改良技术,新兴技术的研究动力。
但离开化学,人类必将寸步难行。
以上只是毫无意义的抱怨罢了,我们回到二氧化碳上来,我想提出三个的问题:
a.我们做一个假设,假设温室效应的主要成因并不是二氧化碳,那我们这样的研究还能够怎样应用?
b.假设这样的技术被应用到极限了,各个工厂疯狂的攫取空气中的二氧化碳,以至于影响到植物的光合作用怎么办?
c.在人类进入星际文明之后,抛弃人类的肉体之前,这样的技术应该怎样在新的领域得到应用。
在之前提过的Science的那篇文章中,[17]作者提到二氧化碳的固定不仅仅是一个调节空气中二氧化碳含量的手段,更是实现了能量的转换与存储的过程。例如,在光化学反应中,人们以这种方式将太阳能存储成化学能,在上文提及的冰岛工厂中,主要是地热能被转化成了化学能,毕竟就现在看来,化学能的存储较之热能,风能,电能什么的要稍微容易一点,尤其是对比较小的独立的生态环境而言。
但二氧化碳的研究课题即使得到了突破性的进展,实现了人工光合作用,最多也只能缓解当前的问题而绝非长远之计。何况人类也不可能长期将自己困于地球之上。对其的研究更可能是一个简单过渡性的权宜之计,也可能在将其解决之前就在其他的能源方面获得了更大的突破,比如说永远还差五十年的可控核聚变。在人类自身的身体构造不发生根本的变化的前提之下,也许可以将该技术自动整合入人工生物圈的反馈调节系统之中实现动态的调控,这样的话也不至于因为过度地消化二氧化碳而出现一些新的问题。当然,如果能够实现的话,这也已经是很多年以后的事情了。
但是一个比较现实的问题是,在化石能源用尽之后,我们怎样得到液体燃料?众所周知的是,在现今的技术层面,很多领域是离不开液体燃料的,比如说航空领域。而即便我们解决了可控核聚变技术之后,也不可能马上就实现小型化的可控核聚变模型,不是么?就像现在的核电站也是先通过烧开水的方法驱动发电机运动从而得到人们日常生活所需要的电能,这方面来说和火力发电什么的并没有区别。而如果要得到液体燃料(主要是碳氢化合物或其他)的话需要使用一些其他的 方法比如说一氧化碳和氢气发生费托反应以及二氧化碳的加氢反应,这种的话实际上就是将其他形式能源中存贮的能量注入化学键的键能之中,而不是往热能,电能方向的转化。从这方面看,对于二氧化碳反应的研究也不仅仅是解决能源问题,更多地可能是提供了一个模板(原料甚至也不一定非要是二氧化碳),这个模板的作用就是指导人们直接将其他形式的能量快速简便的存储在比较轻便易携带利用效率高的液体燃料之中,在一程度上还是有相当大的意义的。
【总结】
总而言之,二氧化碳利用技术的研究,即便不是为了缓解温室效应,也是具有相当大的实际意义的。考虑到这过程往往需要氢气,又联想到光催化,难免不让人联想到现在的另一个人们的研究,即催化光解水。假如我们能够将光解水与二氧化碳加氢的光催化反应联合起来,得到的结果实际上与光合作用非常相似,只不过生成的有机物不同罢了,甚至于与实际的光合作用相比,还有其更有优势的地方,这应该是一个比较有趣的研究方向,值得广大的科研工作者继续为止不懈努力。
[1]
World Resources Institute
[2] Goeppert A, Czaun M, Jones J P, et al. Recycling of carbon dioxide to methanol and derived products–closing the loop[J]. Chemical Society Reviews, 2014, 43(23): 7995-8048.
[3] 傅献彩. 沈文霞, 姚天扬[J]. 物理化学, 1990.
[4] Balaraman E, Gunanathan C, Zhang J, et al. Efficient hydrogenation of organic carbonates, carbamates and formates indicates alternative routes to methanol based on CO2 and CO[J]. Nature chemistry, 2011, 3(8): 609-614.
[5] Richardson R D, Holland E J, Carpenter B K. A renewable amine for photochemical reduction of CO2[J]. Nature Chemistry, 2011, 3(4): 301-303.
[6]
nature.com/nchem/journal/v3/n4/full/nchem.1021.html#auth-1
[7] Meng X, Wang T, Liu L, et al. Photothermal Conversion of CO2 into CH4 with H2 over Group VIII Nanocatalysts: An Alternative Approach for Solar Fuel Production[J]. Angewandte Chemie, 2014, 126(43): 11662-11666.
[8]
en.wikipedia.org/wiki/Fischer%E2%80%93Tropsch_process
[9] Pakhare D, Spivey J. A review of dry (CO 2) reforming of methane over noble metal catalysts[J]. Chemical Society Reviews, 2014, 43(22): 7813-7837.
[10] Chueh W C, Falter C, Abbott M, et al. High-flux solar-driven thermochemical dissociation of CO2 and H2O using nonstoichiometric ceria[J]. Science, 2010, 330(6012): 1797-1801.
[11] Ahlers S J, Bentrup U, Linke D, et al. An Innovative Approach for Highly Selective Direct Conversion of CO2 into Propanol using C2H4 and H2[J]. ChemSusChem, 2014, 7(9): 2631-2639.
[12] Bi Q Y, Lin J D, Liu Y M, et al. Partially reduced iridium oxide clusters dispersed on titania as efficient catalysts for facile synthesis of dimethylformamide from CO 2, H2 and dimethylamine[J]. Chemical Communications, 2014, 50(65): 9138-9140.
[13] Liu X H, Ma J G, Niu Z, et al. An Efficient Nanoscale Heterogeneous Catalyst for the Capture and Conversion of Carbon Dioxide at Ambient Pressure[J]. Angewandte Chemie International Edition, 2015, 54(3): 988-991.
[14] Angamuthu B, Byers P, Lutz M, et al. Electrocatalytic CO2 conversion to oxalate by a copper complex[J]. Science, 2010, 327(5693): 313-315.
[15] North M, Pasquale R, Young C. Synthesis of cyclic carbonates from epoxides and CO 2[J]. Green Chemistry, 2010, 12(9): 1514-1539.
[16] Li Y, Yan T, Junge K, et al. Catalytic Methylation of C H Bonds Using CO2 and H2[J]. Angewandte Chemie, 2014, 126(39): 10644-10648.
[17]
Feature: There’s too much carbon dioxide in the air. Why not turn it back into fuel?
