一、实验的数据来源于哪里?
科研项目成功的关键是什么?合理的实验设计?严谨的实验操作?等这些都是必不可少的因素之一。但是,还有一项目是容易被忽视-样本,所有的实验的数据都来源实验样本,如果想要得到一个好的实验结果,就必须严格的把控实验样本的采集和预处理,保存。
二、常规样本的采集与保存有哪些诀窍?
常规组学样本的采集与保存避坑攻略,总结归纳为以下“七要素”,轻轻松松就能完成样本的收集:
七要素:
一致:实验组与对照组取样一致性,如组织样本组织块的大小、取样部位,血液样本性别年龄的匹配,尿液样本取样时间等;
除杂:去除与实验无关的杂质,如动物组织去血、植物组织去除泥土等污染物、菌体及细胞去除培养基等,推荐使用PBS缓冲液或者生理盐水,吸水纸吸干残留液体;
低温:样本预处理尽量低温,可以在冰上进行杂质去除和分装的操作,低温保存,通常保存在-80℃冰箱;
分装:根据实验用量进行分装,避免反复冻融;
迅速:样本收集,制备,存储和运输应尽可能的迅速,压缩样本采集到正式实验的时间;
标记:用优质的记号笔清晰的标记好样品名称,以免混淆样本;
包装:建议使用优质的离心管、冻存管收集样本,以防在运输和操作过程中样本管破裂以及聚合物对样本造成污染,植物样本可以用锡箔纸包装,锡箔纸外面套一个自封袋以免运输过程中样本洒落。
三、实验室常做的实验样本应该怎么处理?
今天我们来整理一下,一些常规实验样本保存方法及注意事项,包括:分子实验、蛋白实验、病理实验等。
蛋白实验(WB/ELISA)
1.组织样本:取新鲜组织,用无尘纸快速吸去血液,将组织剪成小块,放入装有液氮的锡箔纸中速冻后,放入液氮预冷的离心管中,液氮速冻5min后,-80度保存。
2.细胞样本:收集细胞悬浮液于1.5ml的离心管中,离心去上清,PBS洗涤三次,液氮速冻5min后,-80 ℃保存。
3.血清样本:收集全血,室温放置2h,4℃ 3000rpm/min 离心10min,吸取上部的血清即可,-80度保存。
4.运输条件:干冰运输
全血:新鲜抗凝血,避免剧烈震荡,避免凝血;立即提取。
分子实验(RNA/DNA)
(一)RNA提取(QPCR/测序等)
1.组织样本
组织取材在组织离体 30min 内完成,取样的动作要尽量快速利索,将组织切成任一方向小于 0.5 cm 的薄片(尽可能剪碎),抽取 1ml TRIzol 溶液于 2ml冻存管内,将样本完全浸没于TRIzol溶液(如0.4g样本需要约2.0 mL TRIzol的溶液)。液氮速冻后,-80 度保存。
注意:为完全有效的保护组织样本,该组织样本应完全浸没入 TRIzol 溶液中并且组织样本的任何一边的最大厚度不应超过 0.5 cm。
因为RNA容易降解如不能立即进行提取实验操作可使用储存在 RNAlocker中,细胞或组织可在室温下稳定保存长达1个星期,在4°C可稳定保存长达1个月,或永久保存在-20°C。
2.细胞样本
细胞收集后用PBS缓冲液快速洗一次,每5×106个细胞加入1 ml TRIzol,用枪头反复抽打,直至看不见成团的细胞块,整个溶液呈清亮而不粘稠的状态;液氮速冻,-80 ℃保存。
3.血液样本
1) 加入1 ml TRIzol和 200-300μL新鲜血液(TRIzol:血液 = 3:1-5:1),用移液器吹打几次以帮助裂解样品中的细胞;
2) 样品剧烈震荡混匀1~2 min,直到絮状物全部溶解;
3) 室温孵育5 min以使核蛋白体完全分解;
4) 写好编号,封口膜封存,-80 ℃冻存。
注意:冰冻血液溶解过程中会有破碎的细胞释放RNA酶,因此建议在冰冻前加入TRIzol,切勿直接冻存新鲜血液,保存好的血液应避免反复冻融。
4.运输条件:干冰运输;
(二)DNA提取
1.组织样本
取材后,PBS清洗2-3次,液氮速冻, -80 ℃保存;
2.细胞样本
细胞收集沉淀后,液氮速冻, -80 ℃保存;
3.运输条件:冰袋运输;
病理实验
(一)石蜡切片
1.组织样本
取材后,PBS 清洗 2-3 次,使用 4%多聚甲醛固定,组织样本需完全浸泡在固定液中,固定液的容量应足够,一般固定液与组织块的体积比率应大于 10:1。室温保存。
注意:取材样本要新鲜,否则细胞内溶酶体会破裂,造成细胞自融。
2.细胞样本
细胞爬片后,4%多聚甲醛固定30min,换PBS浸没4度保存。
3.运输条件:常温运输;
4.其他组织保存、固定等
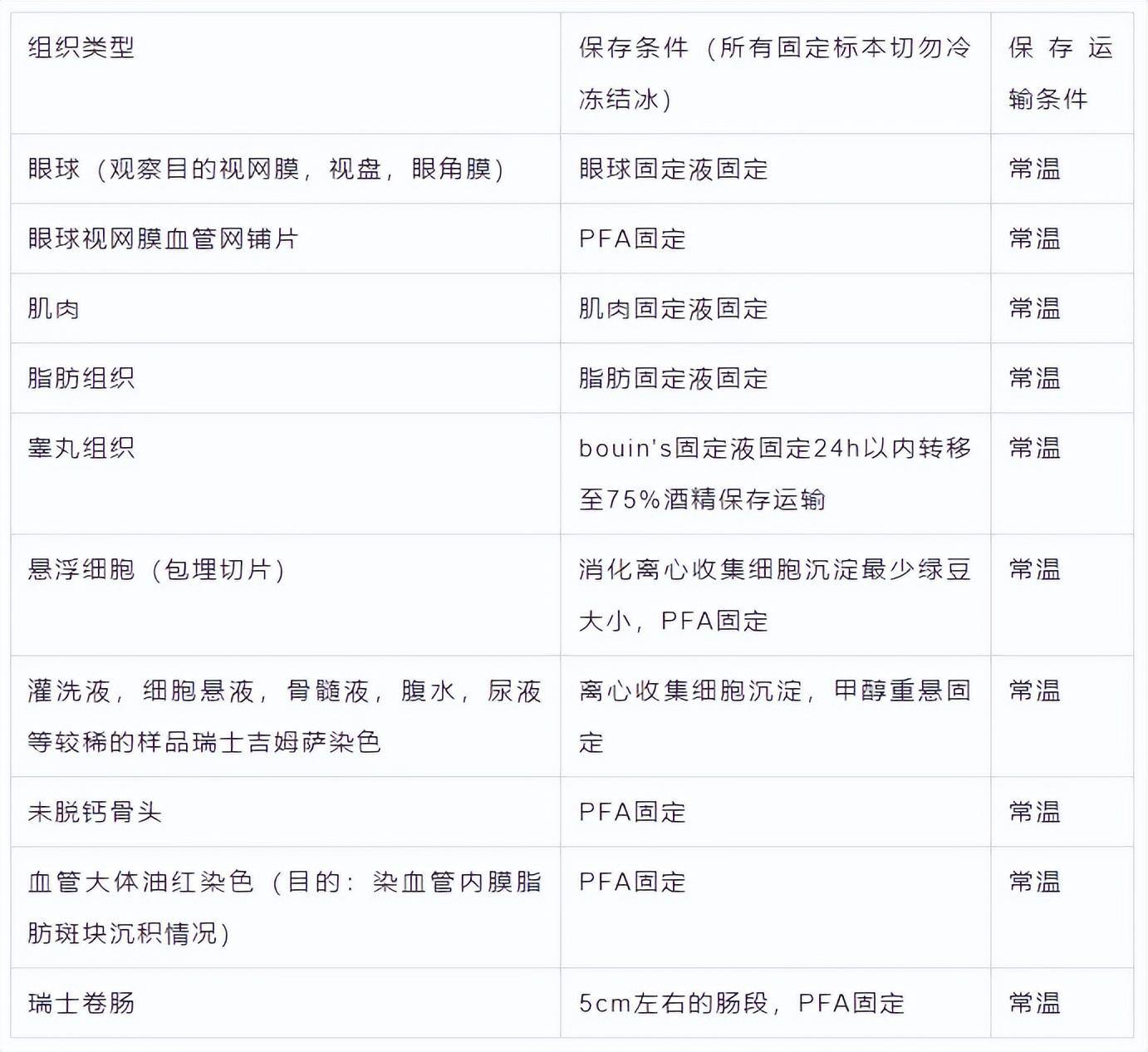
(二)冰冻切片
1.动物组织样本
① 1-3min内取样,取样组织2mmX2mm大小,尽量薄。如来不及修整组织大小可先于电镜固定液内固定半小时左右待组织变硬以后再修整组织进行后固定。超出此范围后组织会无法完全固定,后续实验无法完成,务必请重视此过程。
② 取材时尽量精确到需要观察的目的部位(如观察肾小球取肾皮质;观察胰岛取胰岛丰富的胰尾;皮肤,肠胃等在固定液中易打卷的组织可将组织粘在滤纸上进行固定)。
③ 取材时一定注意避免镊子挤压等机械损伤,刀片要锋利避免挫伤组织。
④ 组织取下后立即投入电镜固定液内室温固定2h,再转移至4℃保存,4℃冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。4℃时样本可保存1个月左右。
2.细胞样本
贴壁细胞:实验目的重点观察细胞连接,将培养好的细胞弃培养基不经漂洗迅速加电镜固定液用细胞刮沿一个方向轻轻刮下细胞收集到离心管内(避免刮破细胞)。实验目的重点观察细胞器,对细胞形态形状无特殊要求,用胰酶消化,离心收集细胞要肉眼可见细胞沉淀芝麻至绿豆大小,弃固定液后加新的电镜固定液室温固定2h,再转移至4℃保存,4℃冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
悬浮细胞:离心收集细胞要肉眼可见细胞沉淀芝麻至绿豆大小,弃培养基后加电镜固定液室温固定2h,再转移至4℃保存,4℃冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。
四、不能立即实验的样品应该怎么长期保存?
相信很多对比组比较多的研究课题一次性会取很多样本,没有办法取材后立即进行试验,需要对大量的样品进行较长时间的保存,那么如何选择合适的保存条件呢?首先我们应该了解不同的储存温度对样品会有哪些方面的影响?
一、储存温度对样本的影响
生物样本的长期储存,通常使用尽可能低的温度来降低样本内的生化反应,以提高样本内各种成分的稳定性。生物大分子、细胞、组织和器官的常用储存温度为 -80℃(超低温冰箱)、-140℃(液氮气相或深冷冰箱)及 -196℃(液氮液相),温度越低样本的稳定保存时间越长。

不同温度对生物样本的影响和保护作用
1) -60~ 0℃ 储存
此温度是水的结晶温度,容易对细胞和组织的微观结构造成损害,一般不使用这一温度来保存组织和细胞。且在组织样本内生物大分子受到细胞组织内多种因素的影响,稳定性有可能明显降低,所以通常样本库不使用 -60~0℃ 作为储存温度。

2)-80℃ 储存
-80℃ 是较常用的样本保存温度,也是常用超低温冰箱所能达到的温度。基于操作简便性、储存量和成本等因素来考量,这一温度也是目前保存样本中生物大分子活性的常用温度。

但对不同的生物大分子活性来说,这一温度下到底能保持多久的问题仍然处于研究探索中。
组织中 DNA 的稳定性较好,可以在 -80℃ 下保持数年或更长时间。但 RNA 则容易被广泛分布于细胞和各种组织里的 RNA 酶降解。RNA 在稳定剂中的储存时间一般不超过 5 年。所以为长期保存 RNA 活性,建议使用更低的温度,或者利用小部分样本提取 RNA 与剩余样本同步储存。其他样本内的蛋白质和脂类等生物大分子在 -80℃ 下也能保存,但时间长短不一,稳定性逐渐衰减。
3)-196℃ 储存
-196℃ 是液氮挥发的温度,所以只有液氮液相保存技术能达到此温度。样本内的生理、生化活动在此温度下基本停止,稳定性状的样本可以得到长期保存。液氮保存是长期保存样本内细胞活性、组织器官的复杂结构及活性的最有效方法,已广为接受与认可。

与其他不同温度冷冻模式相比,液氮容器液相储存样本需要做好防护样本间的交叉污染。美国国家癌症研究所推荐螺旋盖并带有橡胶密封圈的冻存管封装样本。但在降温过程中样本从超低温冰箱(-80℃)转移到液氮中时骤然降温,引起冻存管管帽和管身收缩不一致,容易导致液氮渗入冻存管,从而增加样本间交叉污染的风险。解决的办法之一是可以使用专门的冻存管管套对每个冻存管进行热缩密封,或是使用密封膜在冻存管管帽与管身接口处缠2~3圈再储存。
液氮并不能做到真正无菌,它不能消毒,只能降低细菌、病毒的活性,这种潜在的生物危害会使浸泡在液氮中的样本被污染。因此研究者又发明了一种新的液氮方法——气相液氮罐,将样本置于液氮蒸气中。虽然用气相液氮罐存储样本也不是完全没有风险,致病菌、真菌还是有可能生长,但是因为没有液体介质的存在,从而避免了交叉污染。
五、常见样本储存温度怎么选择?
选择储存温度应考虑样本的类型、预期储存的时间、样本中生物分子的特性、不同细胞的特性。
细菌和细胞的活性临界温度通常认为是 -140℃,在这个温度下,所有的代谢活动都停止,对于能承受在此温度下保存的样本,建议选择低于这个温度进行储存,利于长期稳定的储存。一些样本不能承受这么低的温度,它们的储存温度一般选择 -80℃,在此温度下,代谢活动并没有完全停止。另外,一些经过特殊处理的样本,则可在低温和室温条件下储存。
1)固体组织样本的储存温度:
长期储存的新鲜冰冻组织和 OCT 包埋冰冻组织应储存于液氮中,冰冻组织切片或者用于 DNA 和 RNA 提取的冰冻组织应储存在 -80℃。经过福尔马林固定的石蜡包埋组织及组织切片应储存在室温,在低于 27℃ 的环境下,并控制虫患和湿度。
2)液体样本的储存温度:
对于液体样本,包括血液和尿液,样本里的各种成分应在储存前分离,使得每一种成分能够在最佳条件下储存。全血、血清、血凝块、非淋巴细胞和血浆样本应储存在 -80℃。血沉棕黄层和白细胞应储存在液氮中。尿液应储存在 -80℃ 或者液氮中。
3)细胞的储存温度:
长期保存的细胞系应储存在液氮中。气相液氮比液相液氮储存样本更好。虽然液相液氮的温度更低一些(-196℃),但气相液氮的温度(-150℃)仍在临界温度之下。对于需要但没有条件使用液氮保存的细胞样本,应至少储存 -80℃ 环境中。
六、样本的冻存和取用应该注意什么?
样本储存在稳定的条件下,应避免反复冻融。样本反复冻融会加快生物大分子物质的降解,严重影响样本的质量。样本在冻存前,最好分装成小份样本再储存,可以避免不必要的反复冻融,一般够一次研究用量即可。
当需要冻融样本时,应按照标准流程确保样本的稳定性和质量。样本在冻存过程中应采用合适的冷却速度,控制冰晶大小,以及冰晶形成速度,这些将影响到样本的质量。
样本使用时,需要采取必要的融化和复苏。储存的温度越低,复苏和融化所需的时间越长。当从冷冻状态中解冻时,最好的方式是 37℃ 水浴,过程不宜太长,避免损害样本的生物活性。








