
文章引用
张苗苗,李悦,喻鸿雁,等 . 2022年湖北地区猪流行性腹泻流行病学调查[J].猪业科学,2024,41(5):54-57.
2022年湖北地区猪流行性腹泻流行病学调查
张苗苗1,李 悦2,喻鸿雁2,陈文钦1,向金梅1,王雯熙1,郭妮妮1,宋先荣1,杨 凯1,周 娴1
(1.湖北生物科技职业学院动物(食品)科技学院,湖北 武汉 430073;2.中农华大检测科技有限公司,湖北 武汉 430070)
材料
INTRODUCE
所有病猪材料均来自湖北地区猪场送检的猪腹泻样本。
全自动PCR分析系统(Gentier 48R),购自天隆科技有限公司。核酸提取仪(VNP-32P)购自南京诺维赞医疗科技有限公司。核酸提取试剂盒(Fastpure Viral DNA/RNA Mini Kit V2),购自南京诺维赞医疗科技有限公司,细菌核酸提取试剂盒(Biospin细菌基因组DNA提取试剂盒),购自杭州博日科技股份有限公司。
试验使用南京诺维赞医疗科技有限公司生产的DNA2x荧光反应液、RNA5x荧光反应液、RNA2x普通反应液,以及全式金生物技术有限公司生产的DNA2x普通反应液。所使用的所有上下游引物均为擎科生物科技有限公司合成。
核酸提取及扩增方法
INTRODUCE
2.1 检测病毒样品处理
肠组织:取50~100 mg待检组织样品放入2 mL离心管中,置于组织研磨仪中,加入5倍体积4℃预冷的DEPC-H2O,充分研磨,至无明显组织块,4℃,3 000 rpm离心15 min,取上清转入离心管编号备用。
全血:混匀后编号备用;口腔液:直接取样本编号后备用;精液:可直接取样本备用,若样本较为粘稠,加入等体积PBS或生理盐水进行稀释,室温静置5 min编号后备用;粪便:用棉拭子挑取少许新鲜粪便样品于离心管中,加入1 mL生理盐水,震荡混匀,4℃,
3 000 rpm离心15 min,取上清转入离心管编号备用。其余液体排泄物离心后直接转入离心管编号备用;扁桃体:取出待检样品放入2 mL离心管中,置于组织研磨仪中,加入5倍体积4℃预冷的DEPC-H2O,充分研磨,至无明显组织块,4℃,3 000 rpm离心15 min,取上清转入离心管编号备用。
2.2 检测细菌样本处理
肠组织样本:将样品放置于托盘上置于生物安全柜内,用点燃的酒精棉球灼烧样品表面以达到灭菌目的。用镊子夹起一段组织,剪刀将肠组织剪开缺口,将接种环伸入组织内部进行取样,接种到选择性培养基上平板划线后培养观察(仅适用于大肠埃希氏菌和沙门氏菌)。
粪便样本:直接用无菌接种环蘸取少量粪便样本,接种到选择性培养基上平板划线后培养观察(仅适用于大肠埃希氏菌和沙门氏菌)。
2.3 病毒核酸提取
所有过程均在生物安全柜中进行。向离心管中依次加入20 μL Proteinase K、300 μL处理好的样品(如样本量不足,使用PBS或生理盐水补足至300 μL)、500 μL Buffer VL V2,涡旋混匀15~30 s,短暂离心收集管盖及管壁上的液体,室温静置5 min。
将上述混合液全部转移至纯化柱中,12 000 rpm离心1 min,弃去收集管中的滤液。向纯化柱中加入700 μL Buffer VW1 Plus,12 000 rpm离心30 s,弃去收集管中滤液;向纯化柱中加入700 μL Buffer VW2 Plus,12 000 rpm离心30 s,弃去收集管中滤液;12 000 rpm空柱离心2 min;将纯化柱转移至新的1.5 mL离心管中,向膜中央悬空加入30~50 μL的 RNase-free ddH2O,室温静置1 min,12 000 rpm离心1 min,弃去纯化柱,离心管中为DNA/RNA溶液。
2.4 细菌纯化及核酸提取
煮沸法:沙门氏菌和大肠埃希氏菌分别在沙门氏菌Salmonella shigella agar(SS琼脂培养基)和麦康凯培养基上培养。二者均为选择性培养基,大肠埃希氏菌在麦康凯上生长为粉红色菌落,沙门氏菌在SS琼脂培养基上生长为黑色中心的菌落。挑取培养基上的的可疑单菌落至离心管中,加入200 µL的无菌纯水,煮沸提取核酸。
直接提取法:取500 μL处理好的样品,13 000 ×g离心1 min,弃上清,加入100 μL EL Buffer,混匀,37℃温育10~60 min。
加入100 μL RS Buffer、10μL PK Solution,充分混匀,于56℃温浴15 min。加200 μL GA Buffer,混匀后13 000 ×g离心1 min。将上清液转移到一个新的1.5 mL离心管,加400 μL的 BA Buffer,混匀。将混合液体转移至吸附柱,13 000 ×g离心1 min,弃去接液管中液体。向吸附柱中加入500 μL G Binding Buffer,10 000 ×g离心1 min,弃去接液管液体。向吸附柱中加入500 μL的Wash Buffer,10 000 ×g离心1 min,弃去接液管中液体。
于10 000 ×g离心1 min后并将Spin column转移至一个新的1.5 mL离心管,向Spin column中加入100 μL Elution Buffer,并于室温温育1 min。
于10 000 ×g离心1 min,弃去吸附柱。1.5 mL离心管中液体即为DNA溶液。
PCR体系的配置及PCR仪设置
INTRODUCE
3.1 猪流行性腹泻病毒(PEDV)
2×qRT-PCR Mix 12.5 µL,反转录酶1.0 µL,上游引物F 0.5 µL,下游引物R 0.5 µL,探针P 0.5 µL,RNase-Free ddH2O 5.0 µL;设样品、阴性对照、阳性对照及标准物质总和为N,则按N+1配制体系;加入模板 5.0 μL/孔。
55℃ 15 min;95℃ 30 s;95℃ 10 s、60℃ 30 s,采集荧光信号,共40个循环;冷却35℃ 30 s。选择FAM荧光通道。
3.2猪轮状病毒(RV)
体系配置及扩增程序同2.1。
3.3 猪传染性胃肠炎病毒(TGEV)
2×qRT-PCR Mix 12.5 µL,反转录酶1.0 µL,上游引物F 0.5 µL,下游引物R 0.5 µL,探针P 0.5 µL,RNase-Free ddH2O 5.0 µL;设样品、阴性对照、阳性对照及标准物质总和为N,则按N+1配制体系总体积;加入模板5.0 μL/孔。
55℃ 15 min,95℃ 30 s;95℃ 10 s,60℃ 30 s,采集荧光信号,共40个循环,冷却35℃ 30 s。选择FAM通道。
3.4 猪德尔塔冠状病毒(PDCoV)
体系配置及扩增程序同3.1。
3.5 盖塔病毒(GETV)
反转录酶1.0 μL,2×RT-PCR Mix 12.5 μL,Rnase Free ddH2O 7.5 μL,上游引物 1.0 μL,下游引物 1.0 μL;设样品、阴性对照、阳性对照及标准物质总和为N,则按N+1配制体系总体积;加入模板2.0 μL/孔。
50℃ 30 min;95℃ 5 min;94℃ 30 s、53℃ 30 s、72℃ 30 s共30个循环;72℃ 10 min,保持4℃。
制备1.5%的琼脂糖胶,第一排加入5μL Trans 2K DNA Maker每个胶孔加样5 μL后加入5 μL的阴性对照和5μL阳性对照,点样后120 V恒定电压电泳30 min。使用凝胶成像系统观察并保存试验结果。
3.6 沙门氏菌
2×PCR Mix 12.5 μL,H2O 8.5 μL,上下游引物各1.0 μL;设样品、阴性对照、阳性对照及标准物质总和为N,则按N+1配制体系总体系;加入模板2.0 μL/孔。
94℃ 5 min;94℃ 45 s,60℃ 45 s,72℃ 45 s,共35个循环;72℃ 10 min,保持4℃。
制备1.5%的琼脂糖胶,第一排加入5 μL Trans 2K DNA Maker每个胶孔加样5 μL后加入5 μL的阴性对照和5 μL阳性对照,点样后120 V恒定电压电泳30 min。使用凝胶成像系统观察并保存试验结果。
3.7产气荚膜梭菌(魏氏梭菌)
体系配置及扩增程序同3.6。
3.8 大肠埃希氏菌毒素四联成品试剂盒
设被检样品、阴性对照和阳性对照总和为N,则反应体系配置如表1。
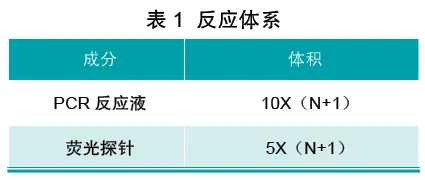
将配置的反应体系充分混匀后,分装每个反应管中各15 μL。再分别取5 μL模板/阴性对照/阳性对照(阴阳对照无需提取,可直接使用),加入相应反应管中,混匀并做好标记。
反应程序设置:在荧光PCR仪上进行以下反应:37℃ 2 min;95℃ 2 min;95℃ 15 s、60℃ 35 s,收集荧光信号,共30个循环。
数据及分析
INTRODUCE
4.1 病毒数据
4.1.1 送检情况
图1为病毒送检数据。
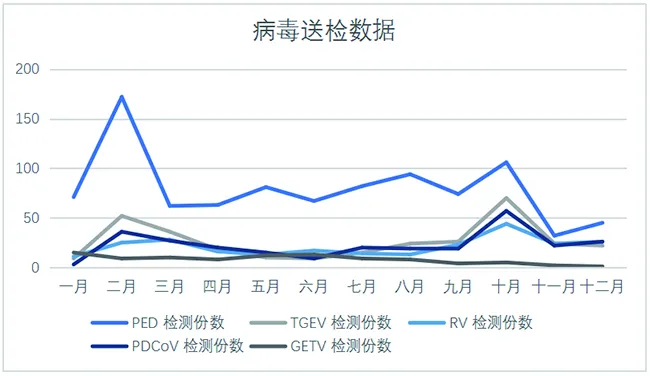
图1 病毒送检数据
通常来说猪厂送检有几种情况,种猪调运、引种监控、发病或死亡、流行病定期监控。猪腹泻病病毒检测全年收到样品1 923份,春季秋季收到样品1 106份,占全年样品送检数的57%,从送检量分析可以初步判断,肉猪饲养过程中猪病毒性腹泻高发季节为春季秋季。而冬季十一月十二月一月的送样量仅333份,仅占全年送样量的17%,湖北省肉猪养殖业冬季发病率较低。
4.1.2 病毒检测阳性数据
图2为病毒检测阳性数据。
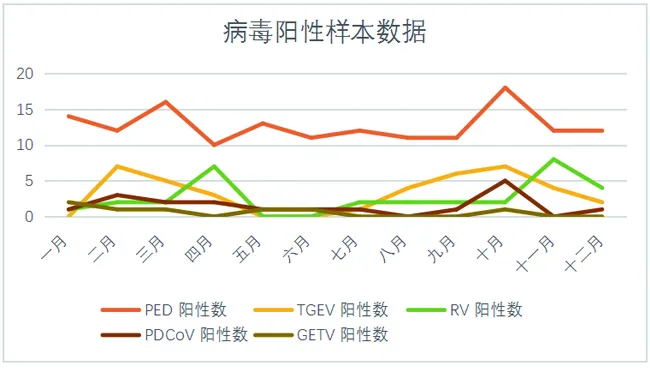
图2 病毒检测阳性数据
从所收集到的病毒性肠胃炎数据结果分析可以发现,湖北地区肉猪养殖行业,肉猪胃肠道病毒性疾病具有较为明显的季节分布特性,春季秋季为高发季节。主要集中在2—3月及9—10月暴发。全年检出病毒阳性样本为248例,PEDV阳性样本数为152例,占全年阳性样本量的61%,从阳性数据来看湖北地区肉猪受PEDV影响最为严重。而同样在全国范围内流行的RV病毒2022年送检样本量不高的情况下阳性检出率仅有12%,由此可以推断,2022年湖北地区养猪业并未受RV病毒影响,或仅在局部地区流行没有发生大面积感染的情况。
GETV全年阳性样本数为7,仅占全年阳性样本量的3%,且检出率不高,由此可以推断湖北地区2022年暂未受到GETV影响。
4.2 细菌数据
4.2.1 送检情况
图3为细菌送检情况。从细菌感染的样品送检数量来看,沙门氏菌具有较强的季节爆发性,在疾病高发的春季秋季沙门氏菌较为易感。
而在动物体内相对常见的大肠埃希氏菌和环境中常见的魏氏梭菌则没有较强的季节感染性特征。三种细菌检测全年的送样数量分别为沙门氏菌140份、魏氏梭菌112份、大肠杆菌毒素146份。
三种菌的检测份数来看较为平均,魏氏梭菌的检测量略少于其他两种,从临床样本来看,细菌感染的混合感染较为普遍且临床症状较为相似,送样时较为盲目普遍存在一份样品三种细菌都检测的现象。
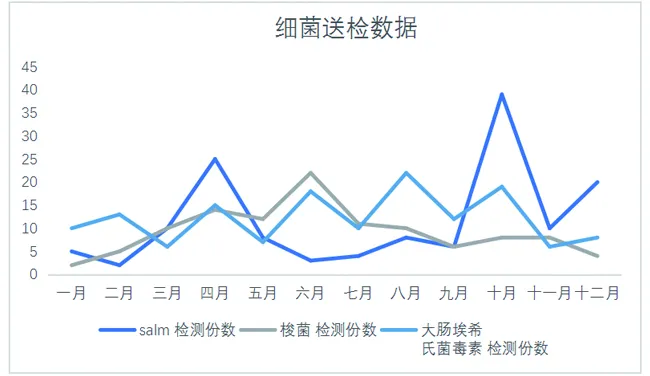
图3 细菌送检情况
4.2.2 细菌检测阳性数据
图4为细菌阳性样本数据。产毒素大肠杆菌的全年阳性检出率为39.0%,沙门氏菌的全年阳性检出率为30.7%,魏氏梭菌的全年阳性检出率为25.0%。
由于三者的检测覆盖样本量较为一致,仅从检出率可以看出产毒素大肠杆菌引起的猪腹泻病在三者中占据主要地位。而不能忽视的一点是三种菌的感染中梭菌为致死率最高的。而产毒素大肠杆菌感染率虽然较高,但多数并不致死,多为混合感染后出现。
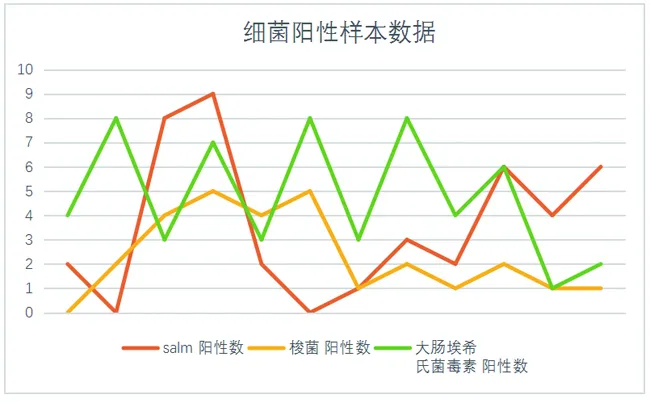
图4 细菌阳性样本数据
结论
INTRODUCE
综合2022年湖北地区肉猪养殖业猪腹泻病数据来看,春秋两个季节发病较多,但从理论上来说病毒性感染在冬季容易高发,细菌性感染在夏季较为高发。该次调查数据以外进一步讨论出现这种情况的原因,可能由于春秋季节气温较为多变,昼夜温差极不稳定,部分猪场没有做好猪舍的温湿度控制,导致肉猪的肠胃应激及抵抗力下降,才造成了春秋季节发病较为严重的情况。
建议在春秋季节气温变化较大的时间段做以下防护:猪舍温度控制、仔猪断水、粪便清理、清群喂养、饲养管理。防止仔猪应激及环境交叉污染。
从送样数量来看,猪病毒性腹泻2022年全年送样量为1 887份,猪细菌性腹泻的全年送样量为398份。从数量上看,猪病毒性腹泻占全年腹泻样本送样总量的82.6%。说明就感染数量和感染复杂程度上看,病毒是肉猪养殖应该重点观察监控的对象。
在病毒和细菌的杀灭上来说,病毒的消杀难度要高于细菌,监控的难度也会高于细菌。
从治疗手段上来说,病毒性感染主要是疫苗免疫的预防为主,细菌感染则是针对性用药对染菌个体进行治疗。
从病毒数据来看,湖北地区主要病毒性感染集中在PEDV和TGEV的感染上,其他病毒的感染局部地区个例全年偶发。
从调查到的细菌数据来看,沙门氏菌的感染有明显的季节分布特征,但产毒素大肠埃希氏菌和梭菌的感染没有明显的季节爆发性,值得注意的一点是,温度回升对于细菌污染的影响,在进入冬季温度下降后细菌感染数量有一定下降趋势。细菌性疾病的预防需要多集中在春季温度回升时期进行,温度持续上升也需要定期严格进行细菌的消杀,同时也对饲料中的细菌进行杀灭。
产毒素大肠杆菌2022年阳性量数据变化不大,是因为大肠杆菌在动物体内普遍常见,甚至产毒素大肠杆菌在健康个体内也有少量分布,仅仅是在个体抵抗力下降或者体内微环境被破坏时,产毒素大肠杆菌成为优势菌群导致个体发病。产毒素大肠杆菌极为易出现在其他疾病的混合感染中,导致个体疾病的加剧。
与病毒感染相反,细菌的易感染季节多为炎热的季节,集中在四到十月之间。主要原因是细菌在个体外的生长和分裂繁殖需要一定适宜的温度和湿度,多为接近体温的34~42℃,湿度高也利于细菌的繁殖。而冬季气温较低且较为干燥不适宜细菌的繁殖,但也需要注意肉猪饲养环境温湿度控制,以及做好定期消杀工作。
该次调查覆盖到了湖北地区猪场,较为客观地反映出了湖北地区2022年猪腹泻病的病原感染情况以及流行情况。湖北地区猪场猪病主要是由于PEDV为主的病毒感染和全年偶发的细菌性感染所导致,因此应该在湖北地区进一步加强对于PEDV的防治工作,也应该注意猪场环境控制及细菌消杀工作。

排版| 乔春玲
校对|乔春玲
审核| 甄梦莹
