今天和大家分享目前最新的SAE报告方式,分享之前,我们先来普及下何为AE,何为SAE?
(Adverse Event,AE)
是指病人或临床试验受试者接受一种药物后出现的不良医学事件,但并不一定与治疗有因果关系。不良事件定义有3个关键点:(1)不良事件是不良的医学事件,即需要判定为“不良的”,而且是“医学事件”;(2)不良事件发生在给予试验用药物之后,但临床试验中关注广泛的安全性信息,通常签署知情同意书后即需要开始收集不良医学事件;(3)不良事件不一定与试验药物有关系,即不良事件与药物不良反应(adversedrugreaction,ADR)在概念上有区别。
因此,不良事件可以是原有症状、体征、实验室异常的加重或新诊断的疾病、实验室异常值等。
严重不良事件
(Serious Adverse Event,SAE)
当不良事件符合以下标准中的任意一项或者多项时,判断为严重不良事件:(1)导致死亡:当一个事件的结果为“死亡”,则可明确作为严重不良事件进行记录和报告;(2)危及生命:在此是指在发生不良事件时患者已经处于死亡的危险中,并不是指假设该不良事件如果更严重可能导致死亡;(3)导致住院或住院时间延长:需明确导致该状况的原因是由于不良事件所致,而非因择期手术、非医疗原因等导致入院;(4)导致永久或显著的残疾或功能障碍;(5)后代先天异常或致畸:受试者的后代存在先天异常和畸形等;(6)其他重要的医学事件:这些不良事件可能没有立刻威胁生命或者导致死亡,但可能危害患者或者可能导致需要干预性措施来预防上述结果的发生,需要基于医学的科学判断来决定。
当不能明确判断是否为严重不良事件时,建议研究者与申办者和伦理委员会进行商讨。
重要不良事件
(Significant Adverse Event)
是指除严重不良事件外,发生的任何导致采用针对性医疗措施(如停药、降低剂量和对症治疗)的不良事件和血液学或其他实验室检查明显异常。
重度不良事件与严重不良事件
应注意到重度不良事件的重度(severe)与严重不良事件中的严重(serious)之间的区别。
“severe”用于定义一个重度的事件,但事件本身导致的后果可能并不严重(如重度脱发)。不良事件的严重程度属于医学严重程度的范畴,需要医学判断,如轻度、中度或重度的心肌梗死。
“serious”是法规的定义,需要满足上述6个条件之一。达到“严重的”标准即必须履行向伦理委员会和监管部门等报告的义务。
01
国 家 局
主管部门:国家药品监督管理局 药品注册管理司
确认电话:010-88331134
1. 传真:010-88363228(首选)
2. 邮箱:yjjdc@nmpa.gov.cn(传真失败时,可用邮箱,PDF格式,需设置请求送达回执并对此进行存档。yjjdc=研究监督处)
3. EMS快递:国家药品监督管理局 药品注册管理司 北京市西城区展览路北霞园1号(邮件仍失败时使用,必须为EMS)
注意:国家局现开通邮箱,为广大报告者提供了便捷的document方式,建议无论传真是否失败,均发送邮件加以确认,并保存。
02
卫 健 委
主管部门:国家卫生健康委员会 医政医管局 医疗安全与血液处
确认电话:010-68792201
1. 传真:010-68792734(首选)
2. 邮箱:saefax@163.com(传真失败时,可用邮箱,必须为PDF格式)
注意:卫健委拒收SAE快递。建议都发送邮件加以确认并保存。
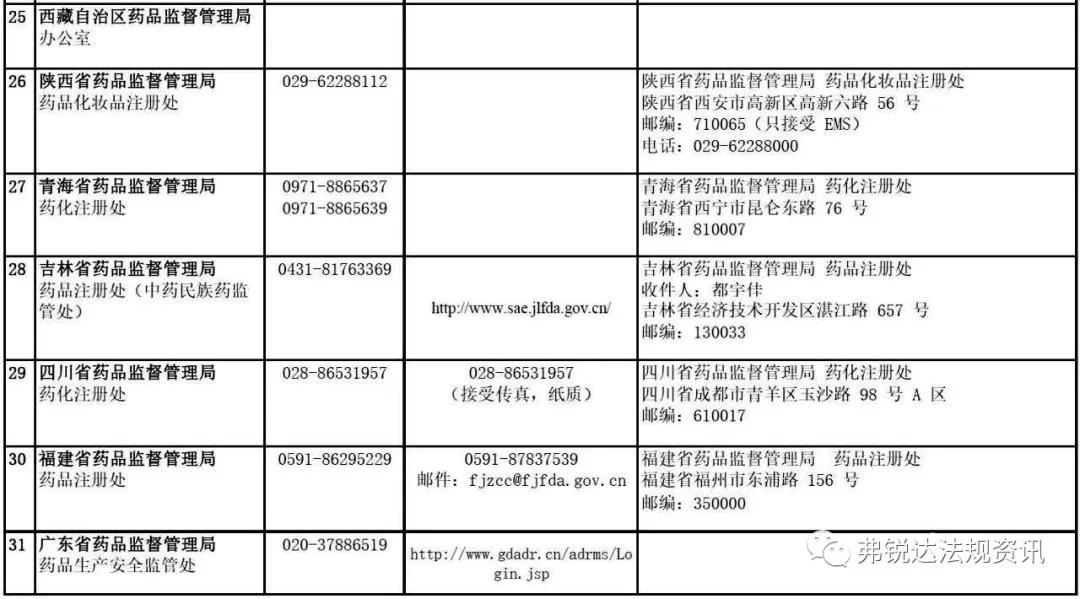
03
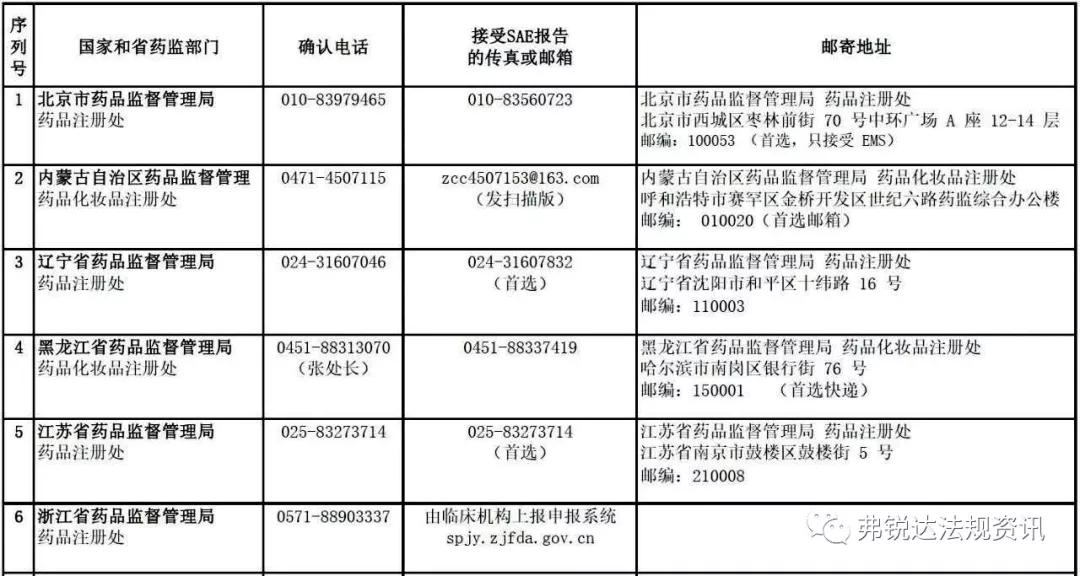
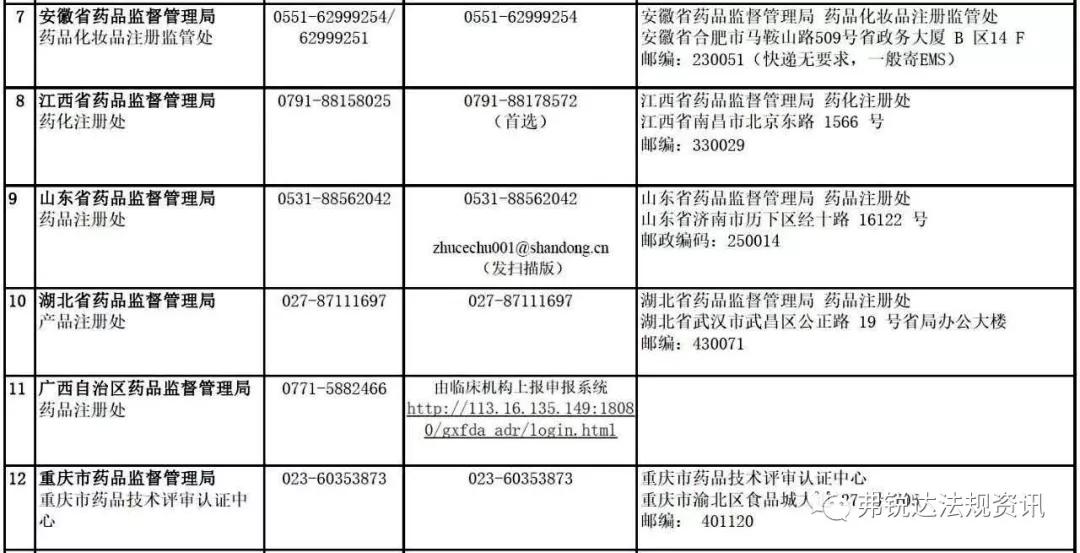
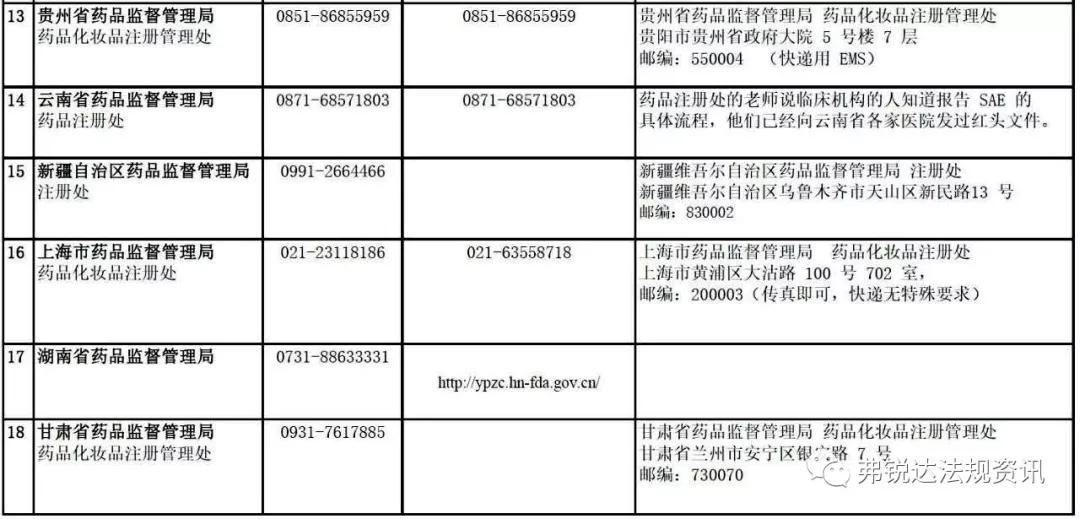
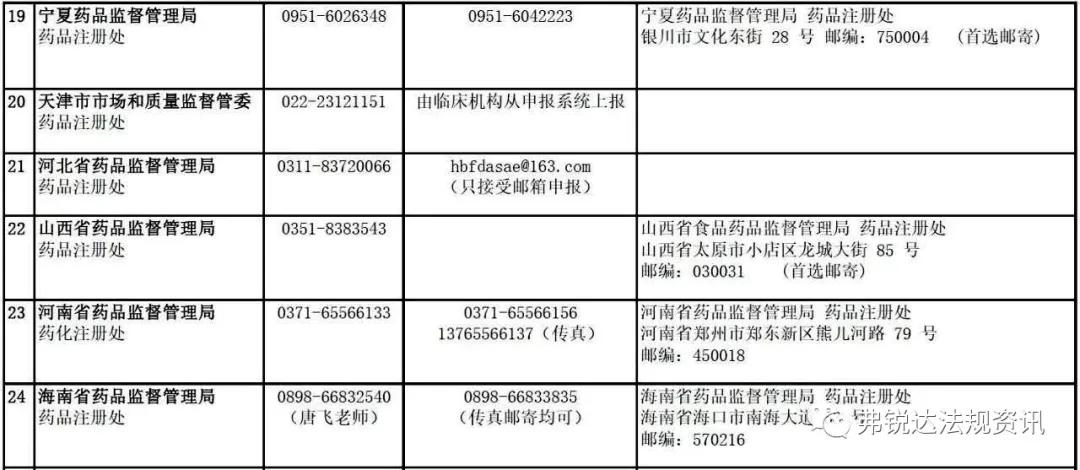
各 省 药 监 局