甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一.回答下列问题:
(1)工业上可用CO2和H2反应合成甲醇.已知25℃、101kPa下:
H2(g)+
O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式:___.
②下列表示该合成甲醇反应的能量变化示意图中正确的是___(填字母代号).
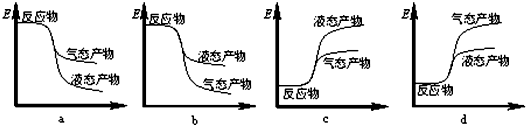
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为___.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如下表所示
(前6min没有改变条件):
2min
4min
6min
8min
′′′
CO
0.07
0.06
0.04
0.05
′′′
H2
0.12
0.12
0.2
′′′
CH2OH
0.03
0.04
0.04
0.05
′′′
①X=___,250℃时该反应的平衡常数K=___.
②若6~8min时只改变了一个条件,则改变的条件是___,第8min时,该反应是否达到平衡状态?___(填“是”或“不是”).
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.___.
(3)甲醇在催化剂条件下可以直接氧化成甲酸.在常温下,甲酸的K=1×10-4,20.00mL0.1000mol/LNaOH溶液与一定量等浓度甲酸溶液混合后所得溶液的c(HCOOH)=c(HCOO-),该溶液pH=___,溶液中离子浓度由大到小的顺序为___.