这个人家科普中国还真没说错,这个还真的是受相对论效应影响的。
首先,先看一下钫在元素周期表中的位置:
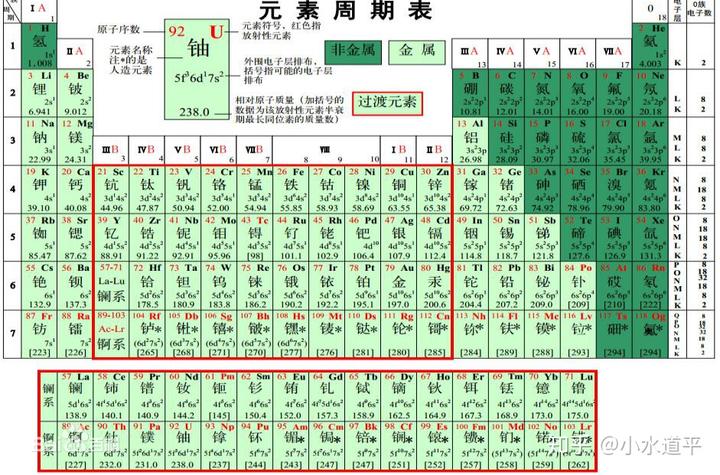
它在第七周期,第一主族。现在的化学基础课程里面一般不提及第七周期的元素,一是由于放射性,二是好多元素发现比较晚。尤其是第七周期元素直到最近才填满。但是一些元素的化学性质是被研究了的。
首先先看一下为什么说第一主族元素从上到下活动性依次增强呢?一般来说是因为最外层轨道的电子能量越来越高,所以越来越活泼。
那么为什么最外层电子会能量越来越高呢?原因是电子层数的增大在这里占据了主要因素,由于电子层数的增加,在最外层的 s 轨道电子离核越来越远,所以能量越来越高。
但是注意:第六周期第七周期完全不一样。这两个周期很特殊。在第六周期最典型的例子就是 6s 惰性电子对效应。(这点对金和汞尤其明显)
首先先解释一下惰性电子对效应,由于我本人是学化学的,这里只能大概解释一下。这个效应是由于内层电子(主要是 n=1 的电子层)过于靠近原子核,在原子核强大的静电引力下,k 层的 s 轨道电子绕核运动速度过快。(这只是一个形象的说法,正确的处理方式需要用到量子电动力学这个我真不会,这种绕核运动仅仅只是形象的说法,实际上是错误的)总所周知,速度是有上限的,即光速。那么电子在接近光速的时候就会产生明显的相对论效应,这使得电子运动轨道更接近于原子核,1s 轨道的屏蔽效应增强,进而导致了外层的 dfg 轨道上的电子轨道膨胀,导致其本身的屏蔽效应降低。从而导致了,最外层的 s 轨道上的电子受核吸引力变大,进而降低能量。
顺便说一下屏蔽效应,由于其他电子对某一电子的排斥作用而抵消了一部分核电荷对该电子的吸引力,从而引起有效核电荷的降低,削弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。(抄的百度百科,手边没资料)斯莱特规则可以近似计算屏蔽效应的大小。
内层电子电子层数如果比最外层电子少两层的话基本上认为其屏蔽常数就是 1 了,也就是说一个电子可以完全的贡献一个负电荷。对于电子层数比较接近的就不一样了,一个电子贡献不了一个净的负电荷。
那么聪明的读者已经发现,金元素已经出现了明显的惰性电子对效应,那么其后面的元素原子核质子数更多,是不是其最外层 s 轨道电子也会出现类似的效应?答案是肯定的,第六周期汞之后的元素基本都反常。例如其之后的三价钅它,四价铅,五价铋的强氧化性,其相应的二价产物都相对稳定。
那么上面这一大段理论解释完之后,我们就知道了 6s,7s 电子实际上轨道是收缩的,是反常的。按照最开始的结论,最外层电子能量越高越活泼,那么钫由于最外层电子 7s 电子电子轨道收缩,能量变低,进而导致相对较稳定,使得其性质反常,活泼性下降。
最后提一句,相对论收缩甚至会导致电子出现分层不明显的现象。

