B .O2-半径比F-的小
C. Na 和Cs属于第IA 族元素,Cs 失电子能力比Na 的强
D . P 和As属于第VA 族元素,H3PO4 酸性比H3 AsO4的弱
标准答案选C。
很少在考试中出现的O2- 与F-比较半径大小的问题,在高考中出现了,且由选答可知O2-半径比F-的大。命题者的依据是:单原子离子(即简单离子)半径大小的比较规律——具有相同电子层结构的简单离子,随原子序数的增加,离子半径逐渐减小(常简称为“序大径小”)。这个规律就没有例外吗?就有文献[1]查得的离子半径数据是:r(O2-)=132 pm,r(F-)=133 pm。这是什么原因呢?
2 理论依据
离子半径[2]是根据实验测定离子晶体中正负离子平均核间距估算得出的,是描述离子大小的一种物理参数。具体的测算方法是:先给定其中一种离子的半径(作为标准离子),再测算出另一种离子的半径,并在此基础上得出其它大量离子的半径。因此,最先给定的离子半径的大小不同,得出的其它离子半径数据就会不同。同时,离子半径的大小还受离子所带电荷、离子本身的电子分布、以及离子晶体结构(如配位数)等因素的影响。
目前仍广泛应用的离子半径主要有4种,其中3种离子半径测算标准对比如表1。

第4种离子半径是由俄国科学家雅茨米尔斯基(Yatsmirskii)提出的,称为热化学半径,从中可以获得多原子离子的大小的印象,如:r(O22-)=159pm,r(NO3-)=165pm,r(CO32-)=164pm,r(NH4+)=151pm等。但是与泡林半径没有可比性。
另有文献[3]关于离子半径的表述是:
离子和原子一样,它们的电子云连续分布在核的周围而没有确定边界,严格地说,离子半径是不能确定的。但是在离子晶体中,相邻正负离子间保持一定的平衡核间距离(r0),可由X射线法测定。因此,假定r0等于正负离子半径之和,若知道了负离子的半径,就可以推算出正离子的半径。其中提出负离子半径标准的几种方案罗列如表2。
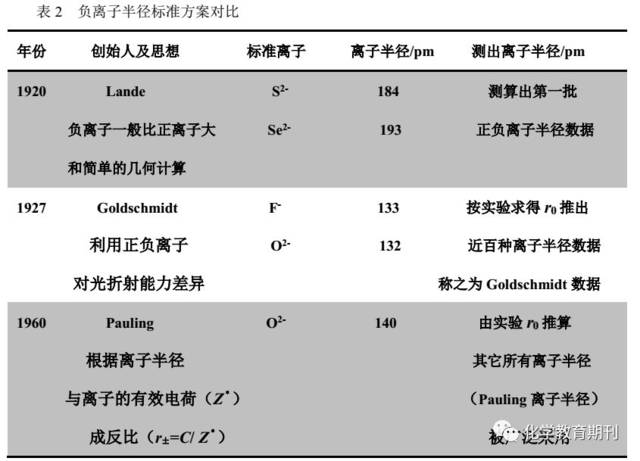
该文献[3]还提到:
在1968年Ladd用电子云密度图提出较新的离子半径数据之后,于1976年Shannon等进一步采用高分辨X射线衍射法求得上千种氧化物和氟化物中正负离子间距离(r0),并以Pauling的r(O2-)=140pm、Goldschmidt的r(F-)=133pm为基准,或以r(O2-)=126pm、r(F-)=119pm为基准,而且考虑到离子在晶体中配位数(C.N.)、电子自旋情况、几何构型等影响,经多次修正,推算出一套较完整的离子半径数据。因正负离子半径和与实验测定的核间距离吻合得最好,故称有效离子半径。有效离子半径概括的数据较多、较精确,目前应用较广。
从以上文献信息可知,尽管离子半径的创始人及年份相比稍有出入,但常用的离子半径数据主要出自三类标准:①r(O2-)=132 pm,r(F-)=133 pm;②r(O2-)=140 pm,r(F-)=136 pm;③r(O2-)=140 pm,r(F-)=133 pm。
3 数据使用的现状
由于离子半径只是一个近似的概念[3],本身并无明确的界限,各种离子半径的划分方案都是在一定假设下推得的结果,其目的都是使推得的正负离子半径的加和值尽可能地与实验测得的各种化合物中正负离子间距离接近。因此,根据使用要求的不同,使用哪一套半径都是可以的。
查询发现,文献[1]使用的是以r(O2-)=132 pm、r(F-)=133 pm为标准的Goldschmidt半径;文献[2][6][8]使用的是以r(O2-)=140 pm、r(F-)=136 pm为标准的Pauling半径,但其中也有少数数据不同,如r(Li+)=60 pm、r(Br-)=195 pm[2],r(Li+)=68 pm、r(Br-)=196 pm[6];文献[4]使用的标准是r(O2-)=126 pm、r(F-)=119 pm;文献[5]使用的则是r(O2-)=140 pm、r(F-)=133 pm为标准的Shannon半径(即有效离子半径)。
正因为如此,文献不同,离子半径的采用数据就不尽一致,颇有点“政出多门”、“乱象丛生”之感。
以高中化学[7]所采用的离子半径为例,与各文献数据列表比较如下。
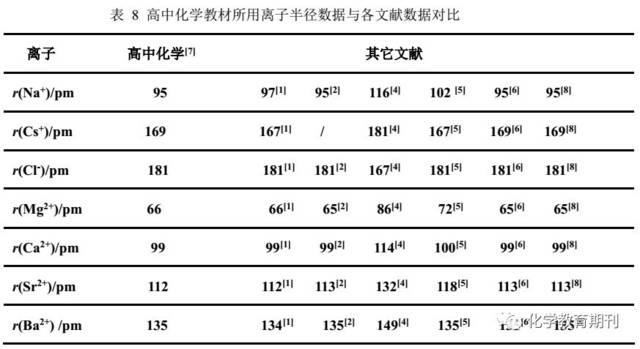
从表8所列离子半径数据看,7种文献中,数据不同的有最多达4种(如Na+、Mg2+、Sr2+),最少的也有2种(如Cl-)。可见“乱象”之一斑。高中化学采用的离子半径数据与文献[2][6][8]数据基本相同,应该是Pauling半径,但也不完全吻合(如Mg2+、Sr2+)。
4 使用建议
尽管表8所列数据对于同一种离子来说不尽相同,但多符合Pauling半径思想[2]之一,即具有相同电子层构型的离子半径随核电荷增大呈比例地缩小。Pauling半径的优点就是给出了比较中学常见简单离子半径相对大小的规律(即常简称为“序大径小”)。
当然,还有Shannon提出的以Pauling的r(O2-)=140pm、Goldschmidt的r(F-)=133pm为基准的二者之折中标准,所得出的有效离子半径也符合上述大小规律。
但是,作为自然科学的化学,应该是规律性与特殊性(即含有反常的)的融合体,因此,一味地只强调数据的规律性而忽视特殊性未必可取。在这点上,V.M.Goldschmidt标度的基础数据提出了r(O2-)=132pm小于r(F-)=133pm这一反常结果,又何尝不是一种符合化学这门自然科学固有特点的客观性呢?由此得出的这种特殊性(或反常)还有[1]:r(Se2-)=191pm小于r(Br-)=196pm、r(Te2-)=211pm小于r(I-)=220pm。
因此,高中化学无论采用什么标准的离子半径数据,则均应该以注脚或其它什么方式说明数据的来源。
既然r(O2-)、r(F-)大小的人为因素较重,所选用标准不同,其相对大小有时恰好相反。因此,建议在命题时,尤其是高考命题,最好规避r(O2-)、r(F-)的大小比较。高中化学[7]里没有给出r(O2-)、r(F-)的大小数据是否就有这种考虑呢。
参考文献
[1]戴安邦,沈孟长. 元素周期表.上海:上海科学技术出版社,1979
[2] 北京师范大学等.无机化学上册.第4版,北京:高等教育出版社,2003:149-151
[3]华彤文,陈景祖等.普通化学原理.第3版,北京:北京大学出版社,2005:273-275
[4][美]菲利普(Phillips,J.S.)等.王祖浩等译.化学概念与应用(中册).杭州:浙江教育出版社,2008:280-281
[5]华彤文,陈景祖等.普通化学原理.第3版,北京:北京大学出版社,2005:497
[6]顾庆超,楼书聪等.化学用表.南京:江苏科学技术出版社,1979:1.9-1.16
[7]吴国庆.化学选修3.物质结构与性质.第3版,北京:人民教育出版社,2009:79-80
[8]严宣申,王长富.普通无机化学.第2版,北京:北京大学出版社,1999:8-27.
微信征稿:观点评述、教学案例、教学心得、微课视频、实验视频、趣味实验、活动报道、科普文章、论文交流、人物事迹、试题评析等,新鲜、热门、有趣、实用,统统都可以,让分享促进你我成长,让传播增强化学力量!如果文章阅读人数超过3000,朋友圈分享人数超过300,则赠送1套全年《化学教育》!投稿邮箱:lichuan1099@126.com,邮件主题请写明“微信投稿”。鼓励原创,若参考了他人的文章,请注明来源,以免引起抄袭和剽窃的争议。








