铂类药物出现于上世纪60年代,自1971年第一位患者接受顺铂治疗至今,已有40多年的发展历程。第三代铂类药物奥沙利铂于1996年在法国率先上市,1999年获准进入中国,已有超过20年临床应用历史。作为大肠癌化疗基石药物,临床上常与5-氟尿嘧啶/甲酰四氢叶酸钙或卡培他滨联合使用,并广泛用于肝癌、胃癌、食管癌、胰腺癌等恶性肿瘤的治疗。今天, 就让我们跟随中山大学肿瘤防治中心临床研究部李苏教授,从药代动力学的角度,剖析奥沙利铂的临床应用……


奥沙利铂结构特异性
无交叉耐药,组织亲和性更高
奥沙利铂为半前体药物,在水溶液中易水解,草酸基团脱落,转化为活性物质。从结构式可以发现,奥沙利铂有着顺铂的顺式结构,以铂为中心,左侧相比顺铂多了二氨基环己烷作为载体基团,以草酸基作为离去基团(图1)。其中, 二氨基环己烷配体具备疏水性,具有较大的空间位阻,阻止了修复蛋白与DNA的结合;由于载体基团不同于其他铂类,从而避免了铂类交叉耐药性的产生[1]。除此之外,二氨基环己烷配体使得奥沙利铂分子体积更大,脂溶性更强,更容易被细胞摄取。药物活性方面,由于奥沙利铂水解速率比卡铂、奈达铂更快,所以活性高于这两者。
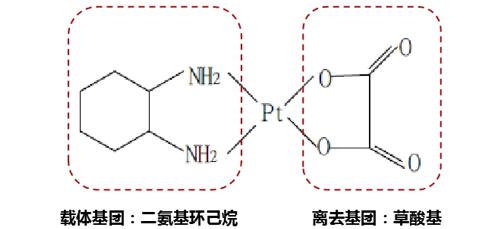
图1. 奥沙利铂分子结构
奥沙利铂药代动力学(ADME)
吸收(A):
奥沙利铂经静脉或动脉给药进入血液循环,不存在吸收过程。
分布(D):
进入血液循环后,其药代动力学参数用超滤铂(游离药物)计算。超滤铂是未与血浆蛋白结合的原型药或代谢物,为奥沙利铂活性形式。在分布过程中最重要的药代动力学参数之一就是表观分布容积(Vd),反映药物被组织摄取的能力,数值越大说明组织分布越大,在组织内停留的时间越长。 超滤铂Vd为400~600 L,与组织亲和力极强。对于实体瘤来说,Vd越大,药物作用越强;反之,对于血液肿瘤希望更多的药物停留在血液中而不是进入组织,Vd越小,药效越强。滴注2h结束时,约85%铂迅速扩散入组织内(约50%)或随尿液(约35%)排出,其余铂停留在体循环中(图2)[2]。在血液中,铂与血浆蛋白(主要白蛋白和γ-球蛋白)和红细胞不可逆地结合,结合率为79%~87%,结合过程缓慢,与血清结合6h达到平衡,与血浆蛋白结合24h达到平衡,结合态奥沙利铂无药理活性[3]。虽然如此,并不用担心奥沙利铂与血浆蛋白结合而失去药理作用,因为只有15%的药物留在血液中,且与血浆蛋白的结合是个漫长的过程,大部分药物迅速分布于组织中,其分布半衰期(从血液分布到组织的时间)为15~25 min [2] 。在临床科研中,如若要进行奥沙利铂血药浓度测定,需检测超滤铂的浓度,而非总铂,可采用超滤膜过滤离心法分离出超滤铂和结合铂。
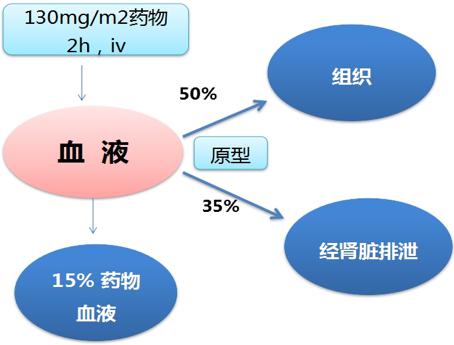
图2. 奥沙利铂在体内的分布及排泄
代谢(M):
奥沙利铂性质不稳定,在体内多种环境下(H 2 O、NaCl)发生水解转化。草酸脱落,转化为含Cl、OH等基团的活性化合物。奥沙利铂在血液中水解引起血液毒性;在组织液水解后产生器官毒性;在肿瘤组织水解后发挥抗肿瘤作用。与大多数药物不同, 由于不属于细胞色素P450 3A4酶(简称CYP3A4)底物,奥沙利铂主要经非酶途径代谢。正因如此,在肝脏代谢时不容易与其他药物发生药物相互作用,肝功能异常和肿瘤发生肝转移也不影响其药物代谢[2][3]。
排泄(E):
主要经肾脏排泄,清除率与肾小球滤过率相当。24h排泄率约为36.8%,低于卡铂(77%),与顺铂接近(28%)[3]。因此,奥沙利铂对肾功能的依赖性小于卡铂。此外,清除率与患者体重和肌酐水平相关,可根据患者这两项指标进行剂量的调整。
奥沙利铂临床使用常见问题
如何避免奥沙利铂提前水解产生草酸造成的静脉刺激
奥沙利铂不可用含NaCl等碱性溶液配制,配置后放置时间过长或温度过高易水解生成活性正离子铂和草酸(说明书规定:制备完成的输注液若不立即使用,应贮藏于2~8℃之间且不超过24小时),草酸酸性甚至强于醋酸,导致给药时对血管造成刺激性。因此,在临床用药时应注意规避、降低奥沙利铂带来的静脉刺激,配置后应尽快使用。此外,不同厂家、批次的草酸含量把控也存在差异,当刺激性过强时可考虑更换成不同厂家或批次的奥沙利铂。
补液和护肝药使用注意事项
碱性药物会加速奥沙利铂的水解,应尽量避免同时使用[2]。任何含氨基酸或蛋白质的补液(白蛋白)或巯基化合物(护肝药)会与游离铂结合,降低抗肿瘤疗效,因此也应避免在化疗当天使用。反之,白蛋白、牛奶、巯基化合物,可作为奥沙利铂过量的解毒剂。
肾功能不全患者透析时机
当肌酐清除率下降时(CrCl游离Pt的暴露[4],或导致毒性增加。透析针对的是血液中的游离铂,游离铂与血清结合6h达到平衡,所以需要在输注6h内进行,建议给药后2~6h内进行透析。
特殊患者剂量调整
低蛋白(白蛋白减低>30%)和贫血患者需降低剂量以减少II级毒性发生;肾功能障碍患者可根据说明书调整或根据群体药代公式调整;轻中度肝功能异常和胆红素异常患者无需调整剂量[2]。
奥沙利铂给药途径探索
奥沙利铂在多癌种中系统化疗地位得到确证。就肝癌而言,由于肝脏有着特殊的双重血供系统,肿瘤组织血供主要来自肝动脉,为其局部治疗的研究开展提供了理论依据。
静脉给药:EACH研究显示FOLFOX方案用于肝细胞癌(HCC)系统化疗疗效显著
EACH研究是一项亚洲多中心,开放标签,随机III期研究,比较晚期HCC患者给予FOLFOX4(奥沙利铂85 mg/m2 iv,d1;亚叶酸钙200 mg/m2 iv d1,2;5-FU 400 mg/m2 bolus,随后持续22h 600 mg/m2 iv,d1-2)对比多柔比星组(50 mg/m2 iv,d1,q3w)的疗效差异。
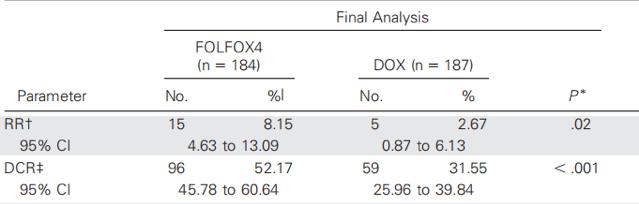
结果表明,与多柔比星相比,FOLFOX4显著提升了无进展生存期(PFS)和总生存(OS)(图3、图4),同时改善了患者应答率(RR)和疾病控制率(DCR)(表),且两组3/4级不良反应发生率无显著差异[5]。随后,EACH研究针对中国人群的亚组分析也证实,以奥沙利铂为基础的全身化疗方案在中国HCC患者治疗中发挥重要作用[6]。
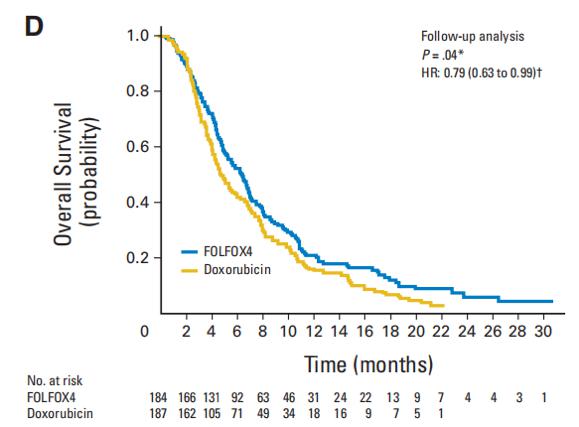
图3. 随访分析中患者OS情况
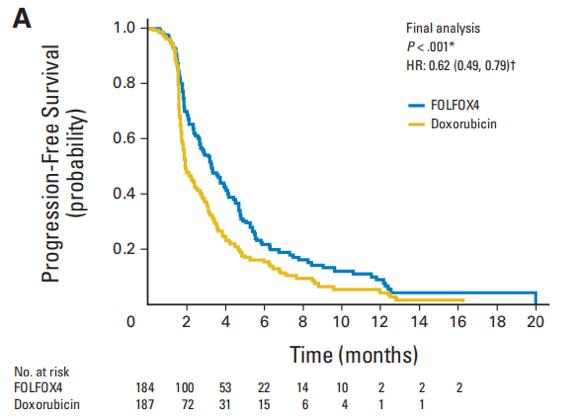
图4. 最终分析中患者PFS情况
表. 最终分析中两组RR和DCR情况
奥沙利铂肝动脉给药探索
EACH研究证实了静脉给药FOLFOX方案在HCC中的有效性和安全性。近年来,基于肝癌治疗不同给药模式动力学差异的深入探索,肝动脉给药这种局部治疗模式越来越受到关注。 正常肝脏组织由门静脉供血,而肿瘤组织血供几乎全部由肝动脉提供,门静脉供血则极少。肝动脉灌注化疗 (HAIC)属于介入治疗的一种,使得药物直接进入肝肿瘤供血动脉,不经过静脉系统,靶区域内化疗药物浓度高于静脉给药,从而减少药物与血浆蛋白的结合,有效降低静脉化疗药物毒副反应(图5)。同时,动脉给药避免了消化道首过效应,提高肝内局部药物浓度。

图5. 两种给药方式区别
奥沙利铂具有组织亲和力高、分布广泛的特点,静脉给药分布到肝脏的有效浓度较低。因此适合进行肝动脉给药来增加局部药物浓度。灌注时间和剂量时影响肝脏摄取率的重要因素,超过肝脏摄取率,过多的药物将进入全身血液循环。目前,奥沙利铂在HAIC最佳的给药模式仍在探索中。
中山大学肿瘤防治中心研究团队发起的一项前瞻性单臂II期研究证实,在索拉非尼中加入FOLFOX的HAIC能为合并门静脉侵犯的HCC患者带来良好生存获益,且毒性可接受[7]。为进一步比较方案之间的优劣性, 研究团队在国内5家医院开展了一项随机、开放性、平行对照III期临床试验,以探究索拉非尼单药治疗和索拉非尼联合HAIC治疗合并门静脉侵犯的HCC患者疗效和安全性。247例患者随机接受索拉非尼联合HAIC(奥沙利铂85mg/m 2 ,亚叶酸钙400mg/m 2 ;5-FU 推注400mg/m 2 ,2400mg/m 2 动脉内灌注46h,每3周1次)治疗或单独索拉非尼治疗(图6),该研究于2019年发表在JAMA oncology上 [8]。

图6. 研究设计
研究结果显示, 与索拉非尼相比,索拉非尼联合HAIC延长了患者中位OS(13.37个月对 7.13个月,P;且索拉非尼联合HAIC组RR(40.8%对2.46%;P)和中位PFS(7.03个月对2.6个月;P)均高于索拉非尼组(图7)。安全性分析显示索拉非尼联合HAIC的治疗方案毒性可接受。
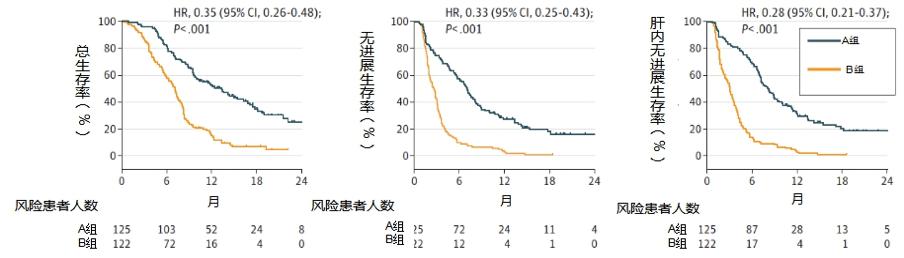
图7. 患者生存获益情况
基于这项研究的结果,在最近更新的泛亚肝癌指南[9]对于BCLC部分B期及C期肝癌做了HAIC治疗推荐(图8)。
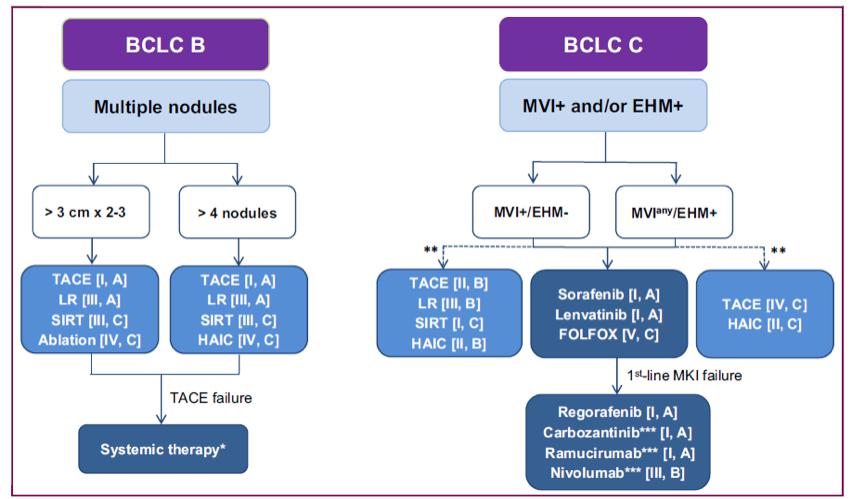
图8. 泛亚肝癌指南HAIC治疗推荐
小结
作为新一代经典铂类药物,奥沙利铂已积累了丰富的临床实践成果,尤其在消化肿瘤领域体现出不俗的治疗价值。随着治疗方案和给药方式不断优化,相信奥沙利铂能为更多肿瘤患者带来福音!
参考文献:
[1] 广东省药学会. 铂类药物临床应用与不良反应管理专家共识. 2018.
[2] 注射用奥沙利铂说明书
[3] Graham MA, et al. Clin Cancer Res. 2000 Apr;6(4):1205-18.
[4] Massari C, Brienza S, Rotarski M, et al. Cancer Chemother Pharmacol. 2000;45:157-64.
[6] Qin S, et al. Oncologist. 2014 Nov;19(11):1169-1178.
[7] He M, et al. Cardiovasc Intervent Radiol. 2018;41(5):734-743.
[8] He M, et al. JAMA Oncol. 2019 Jul 1;5(7):953-960.
[9] Pan-Asian adapted ESMO Clinical Practice Guidelines for the management of patients with intermediate and advanced / relapsed hepatocellular carcinoma: a TOS-ESMO initiative endorsed by CSCO, ISMPO, JSMO, KSMO, MOS and SSO. Chen LT, et al. Ann Oncol. 2020 Mar;31(3):334-351.
互动投票